В чем причины избыточного веса?
Главной причиной избыточного веса у людей в XXI веке является гиподинамия. Непреодолимая тяга к максимальному комфорту портит фигуру. Улучшая собственный быт, человек забывает, что тратит меньше энергии на выполнение повседневных работ. И все излишки обязательно дадут о себе знать, нависнув спереди и сбоку.
Переедание
Переедание является проблемой исключительно новой истории. Пища доступна в любых количествах, в любое время года, но не только объем тарелки пагубно сказывается на здоровье. Мы разучились слушать свой организм. Мы упорно игнорируем все знаки, которые он нам посылает. Мы не знаем продукты, которые организм не воспринимает, выводит или откладывает в виде мусора. Избыточный вес вызывает не килограмм свежего салата с огурчиком и помидорчиком, а именно помидор, например для Иван Иваныча, будет являться катализатором для набора веса, а для Марьи Ивановны это может быть петрушка. Другими словами важен индивидуальный подход к еде. Не стоит гнаться за модой, рестораны фастфуда — не лучшее место для обеда.
Недосыпание
У мало спящего человека нарушается выработка таких гормонов, как лептин и грелин. Первый отвечает за чувство сытости, а второй — голода. При систематическом недосыпании уровень грелина значительно превышает уровень лептина и человек чувствует сильный голод. Это ведет к перееданию и проблемам с лишним весом.
Стрессы
Длительные эмоции отрицательного плана также ведут к набору веса. Этому способствует гормон кортизол, который вырабатывают надпочечники человека, испытывающего негативные эмоции. Лишняя жировая ткань откладывается, главным образом, на животе. Кортизол влияет и на уровень сахара в крови, повышая его. Это ведет к увеличению выработки инсулина и набору лишнего веса.
Если говорить о психологической составляющей, то стресс часто ведет к перееданию. Человек пытается «заесть» свои проблемы куском торта или бутербродом, совершенно не контролируя поток продуктов в организм.
Нарушение работы эндокринной системы — это состояние, при котором железы внутренней секреции или эндокринные железы, выделяющие в кровь или лимфу гормоны, функционируют неправильно. К таким патологиям относят сахарный диабет, заболевания щитовидной железы (гипертиреоз, гипотиреоз), и множество других. К набору лишнего веса ведут лишь некоторые из них, связанные с неправильной выработкой в организме таких гормонов, как:
- Лептин;
- Кортизол;
- Эстроген;
- Инсулин;
- Грелин;
- Группа тиреоидных гормонов.
У людей, страдающих лишним весом, редко обнаруживают патологии секреции лептина. Считается, что у них вырабатывается резистентность к действию гормона. Причины этого до конца на данный момент не изучены.
Эстроген — многопрофильный гормон. Он отвечает за целый ряд функций, в том числе и распределение отложений. Низкий уровень эстрогена ведет к набору веса.
Инсулин вырабатывается поджелудочной железой и необходим для расщепления глюкозы. Нарушение выработки гормона — прямой путь к диабету. Причиной тому является постоянная напряженная работа поджелудочной железы при поступлении больших объемов сахара и крахмала в организм человека.
Грелин — гормон «голода». Как показывают последние исследования, худеющим запрещается терпеть голод более 20 минут.
Гормоны тиреоидной группы производятся в щитовидной железе. Особенно сильно на образование лишнего веса влияет низкий уровень одного из них — тироксина. Поэтому необходимо периодически делать анализ крови на наличие гормонов. Он поможет выявить пониженную функцию щитовидной железы.
Вклад снижения веса в контроль уровня аг
Краеугольным камнем лечения АГ у пациентов с избыточной массой тела или ожирением является непосредственно снижение веса. Не менее важную роль в коррекции уровня АД играет соблюдение низкосолевой диеты. Потеря веса снижает гиперактивацию РААС и СНС, а уменьшение объема висцерального жира позволяет снизить выраженность ИР, что дополнительно способствует натрийурезу.
Основа мероприятий по коррекции массы тела – изменение образа жизни, повышение физической активности и изменение диеты с целью достижения баланса между потреблением и расходованием энергии. Наиболее эффективной и физиологичной следует считать диету со сниженным содержанием насыщенных жиров, повышением доли сложных углеводов, обеспечивающую умеренный дефицит калорийности в 500–600 кКал.
Сочетание повышенной физической нагрузки с калорийными ограничениями приводит к более выраженному снижению веса и изменениям конфигурации тела (жир по сравнению с мышцами), чем только диета или только физическая активность [33]. При недостаточной эффективности немедикаментозных методов лечения или наличии определенных показаний возникает необходимость медикаментозной или даже хирургической коррекции веса тела, но эти мероприятия должны осуществляться только на фоне продолжающихся немедикаментозных вмешательств [34].
Показанием к применению лекарственных препаратов, снижающих вес, является ИМТ ≥30 кг/м2 или ≥27 кг/м2 в сочетании с абдоминальным ожирением, наследственной предрасположенностью к СД 2-го типа и наличием факторов риска сердечно-сосудистых осложнений (дислипидемия, АГ и СД 2-го типа).
Фармакотерапия помогает пациентам уменьшить связанные с ожирением риски для здоровья и улучшить качество жизни. Она также помогает предупредить развитие сопутствующих заболеваний, связанных с ожирением (например, АГ, СД 2-го типа). Определяя медикаментозную тактику лечения ожирения, следует помнить о высокой степени сердечно-сосудистого риска у больных с ожирением и учитывать влияние препаратов центрального действия [35].
Эффективность фармакотерапии следует оценивать через 3 мес. Если достигнуто удовлетворительное снижение массы тела (более 5% у лиц, не страдающих СД, и более 3% у лиц с СД), то лечение продолжают; в противном случае (отсутствие ответа на лечение) препараты отменяют [36, 37].
Считается, что на первых этапах вполне реально снизить вес на 5–10% от исходного, чтобы оценить положительное влияние потери веса на заболевания, связанные с ожирением. Снижение веса на 1 кг приводит к снижению САД на 1,1 мм рт. ст. (95% доверительный интервал (ДИ) 0,7–1,4)
и ДАД – на 0,9 мм рт. ст. (95% ДИ 0,6–1,3) [38]. Уменьшение веса на 5 кг снижает уровень глюкозы у пациентов с СД на 1 ммоль/л, или на 18 мг%, что соответствует эффекту некоторых гипогликемических препаратов, при этом улучшение контроля над углеводным обменом не зависит от способа, которым оно было достигнуто [39].
Эффективность модификации образа жизни в отношении снижения АД у пациентов с избыточной массой тела зависит от величины потери веса. Уменьшение всего на 2 кг посредством диеты может позволить, по данным исследований, снизить САД на 4 мм рт. ст. и ДАД – на 3 мм рт. ст. [40].
Метаанализ 25 рандомизированных исследований показал, что снижение веса на 5,1 кг, достигнутое ограничением калоража, повышением физической активности или сочетанием того и другого, может привести к снижению САД на 4,4 мм рт. ст. и ДАД – на 3,6 мм рт. ст. (табл. 1).
Каждый 1 кг потери веса связан в среднем с уменьшением САД на 1 мм рт. ст. и ДАД – на 0,92 мм рт. ст. Потеря более 5 кг веса связана с более значимым снижением АД: САД в среднем снижается до 6,6 мм рт. ст., а ДАД – на 5,1 мм рт. ст. У пациентов с ожирением II степени (ИМТ 35–39,9 кг/м2)
Физическая нагрузка (аэробные упражнения) приводит к снижению уровня АД у пациентов как с повышенным АД, так и с его нормальным значением. Метаанализ 54 рандомизированных контролируемых исследований позволил сделать вывод, что аэробные упражнения могут снизить САД и ДАД на 3,8 и 2,6 мм рт. ст. соответственно, в то время как потеря веса составила всего 0,4 кг [43].
Характер питания также оказывает благотворное влияние на снижение АД. Наиболее известна DASH-диета (Dietary Approaches to Stop Hypertension). После 8 нед. соблюдения диеты, богатой фруктами и овощами, обезжиренными молочными продуктами, с пониженным содержанием жиров САД и ДАД снизились на 11,4 и 5,5 мм рт. ст. соответственно у лиц с АГ по сравнению с контролем диеты [44].
Положительное действие снижения веса в лечении пациентов с АГ и другими ССЗ может заключаться также в том, что уменьшение количества внутрибрюшного жира ослабляет механическое сдавление почек, что может привести к улучшению их кровоснабжения и снижению активности РААС.
Уменьшение жировой ткани внутри и вокруг почек может привести к снижению интерстициального давления, компрессии тонкой части петли Генле, увеличению кровотока в vasa recta, уменьшению канальцевой реабсорбции Na и воды [46]. Тем самым снижение веса, достигнутое как немедикаментозным, так и медикаментозным воздействием, может позволить скорректировать уровень АД.
Влияние снижения веса на почечную функцию у пациентов с тяжелым ожирением
аличие тяжелого ожирения связано с повышенным артериальным давлением (АД) [1], высоким почечным плазмотоком [2–4], повышенной скоростью клубочковой фильтрации (СКФ) [2,5] и усиленной экскрецией альбумина с мочой [6,7]. Ранее мы изучали клубочковую гемодинамику у пациентов с тяжелым ожирением путем измерения фракционного клиренса декстранов [8]. Анализ прохождения декстранов с использованием теоретической модели транспорта макромолекул через гетеропорную мембрану показал, что клубочковое капиллярное ложе подвергалось повышенному транскапиллярному гидростатическому градиенту давления, что привело к гиперфильтрации. Кроме данных физиологических аномалий многие авторы связывают ожирение с развитием нефротического синдрома и почечной недостаточностью [9–19]. Связанная с ожирение гломерулопатия не так давно была определена морфологически как гломеруломегалия с или без фокального сегментарного гломерулосклероза [20]. Ожирение также может ускорять течение идиопатической гломерулярной болезни, такой как IgA–гломерулопатии [21]. Распространенность связанной с ожирением гломерулопатии, которая может привести к терминальной почечной недостаточности, в течение последних 15 лет увеличилась в 10 раз вследствие «эпидемии» ожирения [22]. Хотя до конца не доказана причинно–следственная связь между клубочковой гиперфункцией при ожирении и развитием нефротического синдрома с почечной недостаточностью, экспериментальные и клинические данные показывают, что гиперфильтрация и гломеруломегалия могут привести к поражению клубочков. Поэтому снижение клубочковой гиперфильтрации может быть эффективным путем профилактики или отсрочки развития почечной патологии при ожирении.
Целью настоящего исследования явилась оценка влияния снижения массы тела на обратимость гломерулярной дисфункции у больных ожирением без развившейся патологии почек.
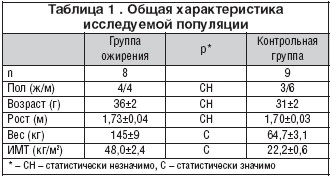
Материалы и методы
Исследуемая популяция
В данном исследовании приняли участие 17 волонтеров (10 женщин и 7 мужчин) в возрасте от 23 до 46 лет. 8 человек страдали тяжелым ожирением (ИМТ>38 кг/м2) и 9 были здоровы и служили контрольной группой. Участники не страдали какой–либо почечной патологией. Никто не получал лечение по поводу гипертензии, сахарного диабета или других хронических заболеваний. У всех выявлен нормальный уровень сывороточного креатинина и отрицательный результат по тест–полоскам для измерения уровня экскреции белка с мочой. Характеристика обеих групп представлена в таблице 1. Распределение по возрасту и полу было сходно в обеих группах. Вес группы больных ожирением в 2 раза превышал вес контрольной группы. ИМТ группы ожирения варьировал между 8,1 и 61,3 кг/м2 у всех кроме одного пациента, который страдал морбидным ожирением, определяемым как ИМТ более 40. Систолическое и диастолическое АД больных с ожирением составило 143±6 (от 122 до 173) и 80±3 (от 66 до 92) мм рт.ст. соответственно. Один пациент страдал АГ 2–й степени (систолодиастолической) и 4 больных – 1–й степени (систолической). Никто не получал лечение по поводу АГ. 3 пациента не страдали АГ. Систолическое и диастолическое АД контрольной группы составило 120±2 мм рт.ст. (от 108 до 129) и 70±3 мм рт.ст. (от 56 до 82) соответственно.
Протокол исследования
Пациентам проводился пероральный глюкозо–толерантный тест (ПГТТ) и функциональные почечные тесты. ПГТТ выполнялся с 8 утра после 10 ч голодания. Пациенты получали 75 г глюкозы, разведенной в воде. Образцы крови забирались через венозный катетер за 10 и 1 мин до и через 60 и 120 мин после введения глюкозы для измерения уровня глюкозы плазмы крови и инсулина. Образцы мочи, полученные за 1 нед. до выполнения почечных функциональных проб, оценивались на уровень мочевины, креатинина и содержания натрия. Функциональные почечные пробы выполнялись на 4–5 дней позже у всех пациентов. Обследование пациентов проводилось в 8 утра после легкого завтрака с низким содержанием белка. Пациенты находились в положении лежа, им устанавливались катетеры в обе руки для инфузии маркеров клиренса и забора крови. Начальная доза инулина составила 50 мг/кг, р–аминогиппуриновой кислоты (РАГ) – 8 мг/кг и декстрана 40–130 мг/кг. Инулин, РАГ и декстран 40 затем вводились медленно капельно. Водная нагрузка (15 мл/кг) давалась в течение первых 60 мин. Четыре определенных по времени сбора мочи производились при самостоятельном мочеиспускании. Периферическая венозная кровь забиралась в рамках каждого сбора мочи. АД измерялось во время каждого сбора мочи.
Пациентам с ожирением проводилась гастропластика с 1–й по 3–ю нед. после выполнения функциональных почечных проб. Почечные функциональные пробы и ПГТТ повторялись не менее чем через 12 мес. после хирургического вмешательства по такому же протоколу.
Девять пациентов контрольной группы и 6 из 8 пациентов с ожирением были частью большой группы, включенной в исследование клубочковой гемодинамики при ожирении [8]. Раствор декстрана 40 вводился для измерения коэффициента прохождения макромолекул у всех участников – пациентов с ожирением, до и после снижения веса, и в контрольной группе. Анализ коэффициента прохождения декстрана в контрольной группе и у лиц с ожирением до хирургического лечения было предметом нашего начального сообщения [8]. Сывороточная и концентрация в моче декстрана не измерялись после снижения веса. Однако раствор декстрана вводился для достижения стандартных условий во время исследования до и после снижения веса.
Лабораторные процедуры
Концентрация инулина и РАГ в моче и плазме определялась колориметрическими методами [23,24]. Уровень глюкозы плазмы, альбумина сыворотки крови, пре–альбумина, сывороточного трансферрина, общее число лимфоцитов и мочевины мочи, креатинин и натрий измерялись с помощью стандартной лабораторной методики. Инулин сыворотки крови измерялся с помощью RIA (Sorin biomedica, Италия). Альбумин мочи измерялся нефелометрическими методами (Beckman, Ирландия).
Расчеты
СКФ определялась по среднему клиренсу инулина. Почечный плазмоток вычислялся путем деления среднего РАГ клиренса на установленное отношение почечного выведения РАГ, умноженное на 0,9. Отношение мочевина/креатинин мочи (мг/мг) и натрий/креатинин (мЕД/мг) использовались для оценки изменения потребления белка и натрия после снижения веса. Среднее АД вычислялось как ДАД 1/3 пульсового давления. Изменения СКФ (ΔСКФ), ИМТ (ΔИМТ), площади под кривой глюкозы и инсулина (ΔAUCглюк и ΔAUCинс) и САД (ΔСАД) после снижения веса выражались в % от начальных значений.
Результаты
Пациенты с ожирением потеряли 48 кг веса в течение от 12 до 17 мес., с 145±9 до 97±7 кг (р<0,0005), и ИМТ снизился на 16 единиц, с 48±2,4 до 32,1±1,5 кг/м2 (p<0,0001). Несмотря на такое снижение ИМТ остался повышенным в сравнении с контролем – 22,2±1,7, р<0,0001.
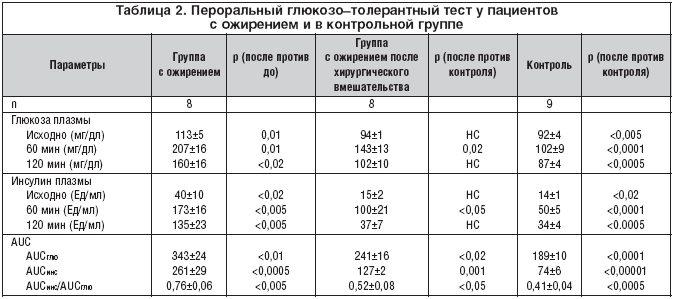
ПГТТ
В таблице 2 суммированы результаты ПГГТ. Уровень глюкозы в крови натощак был выше в группе ожирения в сравнении с контролем, все значения были ниже 140. Уровень инсулина натощак был повышен почти в 3 раза в группе ожирения. Площадь под кривой (AUCглю) глюкозы и инсулина в группе ожирения были повышены на
80 и 250% соответственно, в сравнении с контролем. Отношение площадей под кривой «инсулин к глюкозе» в группе ожирения было повышено на 85%, что указывает на инсулинорезистентность.
После хирургического вмешательства уровень глюкозы натощак и инсулина значительно снизился. Отношение площадей под кривой «инсулин к глюкозе» снизилось на 32%, достигая значния 27% сверх нормального. Эти результаты указывают на улучшение инсулинорезистентности.
Нутриционные параметры
Отношение мочевина/креатинин мочи снизилось с 17,1±1,9 до 11,8±1,3 (р<0,05) после снижения веса. Отношение натрий/креатинин мочи снизилось с 0,16 ±0,01 до 0,12±0,02 (р<0,05). Альбумин сыворотки крови составил 4,2±0,1 до хирургического вмешательства и 4,3±0,1 мг/дл после снижения веса (СН). Преальбумин сыворотки крови составил 27,3±3,1 до и 25,3±1,0 мг/дл после снижения веса (СН). Трансферрин сыворотки крови был 312±13 до и 314±21 мг/дл после снижения веса (СН). Общее число лимфоцитов составило 1946±186 до и 1728±146/мм3 после снижения веса (СН).
Динамика фильтрации
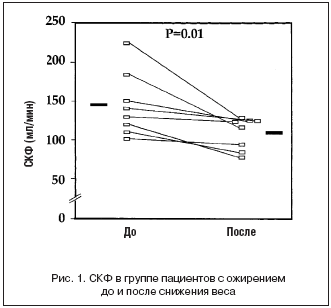
Динамика фильтрации и артериального давления (АД) показаны в таблице 3. В группе больных с ожирением, САД было в пределах нормальных значений. Диастолическое и среднее АД были нормальными. Однако эти значения были выше чем в контрольной группе.
СКФ была на 61% выше в группе ожирения, чем в контроле. Она была повышена у 6 из 8 пациентов. Повышение почечного плазмотока было пропорционально меньше, в среднем на 32%. Повышение СКФ было, таким образом, связано с повышением фильтрационной фракции. После снижения веса СКФ и ПП снизились на 24 и 13% соответственно (рис. 1 и 2). САД снизилось на 10 мм рт.ст. ДАД осталось на таком же уровне, и среднее АД снизилось незначительно.
Экскреция альбумина с мочой
После снижения веса, уровень экскреции альбумина с мочой снизился с 16 μг/мин (4 до 152 μг/мин) до 5 г/мин (от 3 до 37 μг/мин), р<0,01 и фракционный клиренс альбумина снизился с 3,2х10–6 (1,1 до 23х10–6) до 1,2х10–6 (0,5 до 6,8х10–6), р<0,02.
Предикторы изменения СКФ
По унивариантному анализу ΔСКФ коррелировала с ΔAUCглю (r=0,76, р<0,03). Корреляция между ΔСКФ и ΔИМТ достигла статистической значимости (r=0,69, р=0,059). ΔAUCинс (r=0,33, р=СН) и ΔСАД (r=0,37, р=СН) не были предикторами ΔСКФ. При мультивариантном анализе следование ΔСАД за ΔAUCглю привело к увеличению корреляции с ΔСКФ, r=0,95, р=0,01.
Обсуждение
Данное исследование показало, что такие нарушения почечной гемодинамики, как, например повышенные СКФ, ПП, альбуминурия, связаны с тяжелым ожирением и значительно улучшаются после снижения веса. Ранее было показано [2–4,8], что вызванная ожирением гиперфильтрация связана с повышением ПП, что дает основание думать о состоянии почечной вазодилатации, в особенности афферентной артериолы. Группа больных ожирением имела более высокое САД и АДср, чем контроль. Мы ранее анализировали АД по прохождению макромолекул в клубочке при помощи гетеропорной модели, имитирующей селективность клубочка [8], в группе из 12 больных, страдающих ожирением крайней степени выраженности (в группу вошли 6 из 8 пациентов, участвующих в настоящем исследовании). Данный анализ показал, что повышенный транскапиллярный градиент давления играет роль в повышении СКФ, повышенное клубочковое давление возникает за счет трансмиссии повышенного аритериолярного давления через дилатированную клубочковую афферентную артериолу.
После снижения веса СКФ, ПП и ФФ значимо снизились. ПП нормализировался, в то время как СКФ осталась немного повышенной. Данное улучшение было связано со снижением альбуминурии. Это уменьшение альбуминурии было вызвано снижением не СКФ, а фракционного клиренса альбумина.
Настоящее исследование – первое, которое показывает, что СКФ, ПП и МАУ снижаются после снижения веса у пациентов, страдающих ожирением. Лишь в 1 работе ранее опубликованы данные по влиянию снижения веса на почечную функцию [5], которое показало, что СКФ снижается после интестинального хирургического вмешательства с наложением обходного пути у пациентов с ожирением. Однако в том исследовании не было данных по ПП, АЛ и альбуминурии. Кроме того, состояние мальабсорбции, ассоциированное с наложением обходного пути, зачастую ведет к значимой мальнутриции. В настоящем исследовании пациентам выполнялась гастропластика и не выявлено биохимических маркеров мальнутриции после снижения веса.
Мы хотим подчеркнуть, что СКФ в настоящем исследовании не была скорректирована по площади поверхности тела. Число нефронов не увеличивается с увеличением жировой ткани, следовательно, ожирение должно приводить к увеличению СКФ отдельных нефронов. Абсолютная СКФ отражает данный феномен, в то время как скорректированная СКФ скрывает это. Мы проанализировали данную информацию путем использования данной нескорректированной, абсолютной СКФ.
Каковы отдаленные последствия улучшения гемодинамических возможностей клубочка?
Вызванная ожирением патология почек была впервые выявлена почти 3 декады назад [9]. За прошедшее время опубликовано множество статей [10–20]. Эта гломерулопатия часто дебютирует в виде нефротического синдрома, с или без почечной недостаточности. Распространенность клубочковой патологии среди больных ожирением неизвестна. В недавней публикации было сообщено, что распространенность вызванной ожирением гломерулопатии, морфологически определенной как гломеруломегалия с или без фокального гломерулосклероза, выросла в 10 раз за последние 15 лет [20]. Патогенез заболевания неизвестен. Однако, учитывая, что клубочки пациентов с тяжелым ожирением подвергаются повышенному транскапиллярному фильтрационному градиенту давления и повышенному уровню фильтрации [8], интересно предположение о том, что эти физиологические аномалии лежат в основе повреждения клубочков. Brenner и соавт. [25,26] 2 десятилетия назад предположили, что адаптивные изменения клубочка происходят после снижения функциональной массы почки, и эти изменения лежат в основе начала и прогрессирования гломерулосклероза. Клубочковая гипертензия, гиперфильтрация и АГ ведут к истончению капиллярной стенки клубочка, поражению клеток эндотелия и эпителия и транссудации макромолекул в мезангиум [27]. Это приводит к мезангиальной перегрузке и дисфункции [28,29] и со временем к разрастанию мезангия и склерозу [30]. Данный механизм, подтвержденный экспериментальными данными, предположительно вносит вклад в прогрессирование диабетической нефропатии в диабетической почке с гиперфильтрацией [31,32]. Клубочковая гиперфильтрация и гипертензия связаны с гипертрофией клубочоков в оставшейся части модели почки и модели диабетической почки. Предполагается, что гипертрофия клубочка также приводит к развитию гломерулосклероза [33] путем повышения напряжения стенки клубочка [34] и натяжения и поражения эпителиальных клеток клубочка [35].
Как было показано в настоящем исследовании и ранее проведенных работах [2,5,8], почка пациента с ожирением разделяет функциональные патологии, такие как почечная вазодилатация и гиперфильтрация, с диабетической почкой, делая ее восприимчивой к поражению. Важно, что снижение площади под кривой глюкозы после снижения веса было предиктором изменения СКФ. Однако данная находка не обязательно является причиной и влияет на взаимоотношение между нарушенной толерантностью к глюкозе и гиперфильтрацией и может отражать тот факт, что оба фактора независимо улучшают последующее снижение веса.
В настоящем исследовании повышенный ПП и СКФ снижались после уменьшения веса. Опираясь на факт, что число клубочков остается неизменным в течение исследования, данное изменение отражает снижение плазмотока отдельного нефрона и СКФ отдельного нефрона. Снижение ПП говорит о том, что афферентная артериола клубочка стала менее дилатированной, таким образом передавая меньшее давление на капиллярное ложе клубочка. Снижение капиллярного гидростатического давления (КГД) даже более заметно, поскольку системное АД также снижается. Таким образом, капиллярное гидростатическое давление снизилось с помощью 2 механизмов: снижения системного АД и повышения резистивности афферентной артериолы. Кроме того, снижение ПП может повлиять на СКФ независимо от изменений гидростатического давления: это снижение предположительно вызывает повышение интралюминальной концентрации макромолекул, поскольку кровяные потоки максимальны вдоль капилляров клубочка [36]. Это приводит к повышению интракапиллярного онкотического давления клубочка, таким образом уменьшаются силы, способствующие клубочковой ультрафильтрации. Важно, что СКФ снизилась у всех пациентов в настоящем исследовании, ПП не снизился у 2 из этих пациентов. Причина дисбаланса между изменениями СКФ у всех пациентов и недостаточным снижением ПП неизвестен. У одного пациента из двоих ПП был в пределах нормальных значений до снижения веса – факт, который может объяснить недостаточное изменение после снижения веса. Однако данная находка противоречит данным, что СКФ может изменяться вне зависимости от изменения ПП.
В итоге фракционная экскреция альбумина снизилась вслед за снижением веса. Механизмы, связывающие нарушения клубочковой гемодинамики и фракционный клиренс альбумина, непонятны. Повышенный фракционный клиренс альбумина может быть теоретически связан с нарушением селективности клубочковой мембраны по размеру или по заряду или со снижением тубулярного катаболизма альбумина. Исследование коэффициента прохождения молекул фракционированного декстрана показало, что МАУ не связана с нарушением селективности по размеру [37]. Таким образом, повышенная экскреция альбумина может возникать вследствие нарушения селективности клубочка по заряду или снижения тубулярного катаболизма. Результаты недавних исследований позволяют выдвинуть версию, что повышенное клубочковое давление может повышать экскрецию альбумина путем влияния на метаболизм клеток клубочка:β, который может повреждать лизосомальные ферменты активности в клетках канальцев [41,42]. Это ведет к повышенной экскреции альбуминов с мочой независимо от нарушенной клубочковой селективности, как показано на модели вызванной гипертензией альбуминурии [42]. Далее повышенная экскреция альбумина у пациентов без сахарного диабета может привести к системной эндотелиальной дисфункции, независимо от местных гемодинамических нарушений клубочка. Ожирение связно с эндотельной дисфункцией [43–47], которая является одним из факторов, учитывающихся при повышенной сердечно–сосудистой заболеваемости среди лиц с ожирением [48,49]. Таким образом, возможно, что снижение альбуминурии после уменьшения веса отражает положительное влияние похудения на интегральный показатель системной капиллярной сети. Несмотря на патогенез альбуминурии пациентов с ожирением пониженная фракционная экскреция альбумина после снижения веса отражает улучшенную клубочковую и/или системную капиллярную функцию. растягивание мезангиальных клеток повышенным давлением [38–40] повышает продукцию TGF–
Улучшение клубочковой гемодинамики после снижения веса, показанное в настоящем исследовании, было связано со снижением АД, которое коррелирует при мультивариантном анализе с изменениями СКФ. Reisin и соавт. [50] показали, что снижение веса у пациентов с АГ и избыточным весом приводит к снижению АД и что это снижение не зависит от снижения потребления соли. Hall и соавт. [51] на экспериментальной модели доказали, что ожирение связано со значимой задержкой натрия. Hall [52] предположил, что повышенная канальцевая реабсорбция натрия приводит к сниженной доставке соли к maculа densa, что ведет к вазодилатации артериол клубочка и повышению ПП и СКФ. Эта гипотеза связывает вызванную ожирением гипертензию и гиперфильтрацию. Снижение СКФ и АД после снижения веса совместимо с этой гипотезой, однако ее еще надо доказать.
Данное исследование поведено среди пациентов, не страдающих почечной патологией. Гиперфильтрация может играть роль не только в патогенезе гломерулопатии при ожирении, но и в прогрессировании других гломерулопатий. Недавнее исследование показало, что IgA–нефропатия прогрессирует быстрее у пациентов с ожирением, чем у пациентов с нормальным весом [21]. Эта находка и результаты настоящего исследования говорят о том, что снижение веса может положительно влиять на течение хронической почечной недостаточности путем снижения клубочковой гиперфильтрации при ожирении. Таким образом, в связи с увеличивающейся распространенностью ожирения [22] и патологии почек при ожирении [20,21] эти результаты имеют важную теоретическую и практическую ценность.
Итак, снижение веса улучшает почечную гемодинамику и может замедлять прогрессирование почечной недостаточности у пациентов с ожирением с патологией клубочков.
Реферат подготовлен Е.К. Ершовой по материалам статьи A. Chagnac, T. Weinstein, M. Herman, et al. «The Effects of Weight Loss on Renal Function
in Patients with Severe Obesity»,
J Am Soc Nephrol 2003; 14: 1480–1486.


Литература
1. Must A, Spadano J, Coakley FH, Field AE, Colditz G, Dietz WH: The disease burden associated with overweight and obesity. JAMA 282: 1523–9, 1999
2. Ribstein J, du Cailar G, Mimran A: Combined renal effects of overweight and hypertension. Hypertension 26: 610–615, 1995
3. Reisin E, Messerli FG, Ventura HO, Frohlich ED: Renal haemodynamic studies in obesity hypertension. J Hypertens 5: 397–400, 1987
4. Porter LE, Hollenberg NK: Obesity, salt intake and renal perfusion in healthy humans. Hypertension 32:144–148, 1998
5. Brochner–Mortensen J, Rickers H, Balslev I: Renal function and body composition before and after intestinal bypass operation in obese patients. Scand J Clin Lab Invest 40: 695–702, 1980
6. Metcalf P, Baker J, Scott A, Wild C, Scragg R, Dryson E: Albuminuria in people at least 40 years old: Effect of obesity, hypertension, and hyperlipidemia. Clin Chem 38: 1802–1808, 1992
7. Valensi P, Assayag M, Busby M, Paries J, Lormeau B, Attali JR: Microalbuminuria in obese patients with or without hypertension. Int J Obes Relat Metab Disord 20: 574–579, 1996
8. Chagnac A, Weinstein T, Korzets A, Ramadan E, Hirsch J, Gafter U: Glomerular hemodynamics in severe obesity. Am J Physiol Renal Physiol 278: F817–F822, 2000
9. Weisinger JR, Kempson RL, Eldridge FL, Swensen RS: The nephrotic syndrome: A complication of massive obesity. Ann Intern Med 81: 440–447, 1974
10. Kasiske BL, Crosson JT: Renal disease in patients with massive obesity. Arch Intern Med 146: 1105–1109, 1986
11. Warnke RA, Kempson RL: The nephrotic syndrome in massive obesity: A study by light, immunofluorescence and electron microscopy. Arch Pathol Lab Med 102: 431–438, 1978
12. Wesson DE, Kurtzman NA, Frommer JP: Massive obesity and nephrotic proteinuria with a normal renal biopsy. Nephron 40:235–237, 1985
13. Jennette JC, Charles L, Grubb W: Glomerulomegaly and focal segmental glomerulosclerosis associated with obesity and sleep apnea syndrome. Am J Kidney Dis 10: 470–472, 1987
14. Lamas S, Sanz A, Ruiz A, Alvarez J, Mejia F, Rodriguez–Puyol D: Weight reduction in massive obesity associated with focal segmental glomerulosclerosis: Another evidence for hyperfiltration? Nephron 56: 225–226, 1990
15. Bailey RR, Lynn KL, Burry AF, Drennan C: Proteinuria, glomerulomegaly and focal glomerulosclerosis in a grossly obese man with obstructive sleep apnea syndrome. Aust N Z J Med 19:473–474, 1989
16. Shimomura Y, Murakami M, Shimizu H, Uehara Y, Takahasi M, Inukai T, Kobayashi I, Kobayashi S: Improvement of nephrotic syndrome in a massively obese patient after weight loss and treatment with an anti allergic drug. J Med 21: 337–347, 1990
17. Praga M, Hernandez E, Adres A, Leon M, Ruilope LM, Rodicio JL: Effects of body–weight loss and captopril treatment on proteinuria associated with obesity. Nephron 70: 35–41, 1995
18. Praga M, Morales E, Herrero JC, Perez–Campos A, Dominguez–Gil B, Alegre R, Vara J, Martinez MA: Absence of hypoalbuminemia despite massive proteinuria in focal segmental glomerulosclerosis secondary to hyperfiltration. Am J Kidney Dis 33:52–58, 1999
19. Adelman RD, Restaino IG, Alon US, Blowey DL: Proteinuria and focal segmental glomerulosclerosis in severely obese adolescents. J Pediatr 138: 481–485, 2001
20. Kambham N, Markowitz S, Valeri AM, Lin J, D’Agati VD: Obesity–related glomerulonephropathy: an emerging epidemic. Kidney Int 59: 1498–1509, 2001
21. Bonnet E, Deprele C, Sassolas A, Moulin P, Alamartine E, Berthezene F, Bertoux F: Excessive body weight as a new independent risk factor for clinical and pathological progression in primary IgA nephritis. Am J Kidney Dis 37: 720–727, 2001
22. Mokdad AH, Serdula MK, Dietz WH, Bowman BA, Marks JS, Koplan JP: The spread of the obesity epidemic in the United States, 1991–1998. JAMA 282: 1519–1522, 1999
23. Schreiner GE: Determination of inulin by means of resorcinol. Proc Soc Exp Biol Med 74: 117–120, 1950
24. Brun C: A rapid method for determination of paraaminohippuric acid in kidney function tests. J Lab Clin Med 37: 955–958, 1951
25. Brenner BM: Hemodynamically mediated glomerular injury and the progressive nature of kidney disease. Kidney Int 23: 647, 1983
26. Brenner BM, Meyer TW, Hostetter TH: Dietary protein intake and the progressive nature of kidney disease. New Eng J Med 307: 652–660, 1982
27. Olson JL, de Urdaneta AG, Heptinstall RH: Glomerulohyalinosis and its relation to hyperfiltration. Lab Invest 52: 387–398, 1985
28. Grond J, Elema JD: Glomerular mesangium. Analysis of the increased activity observed in experimental acute aminonucleoside nephrosis in the rat. Lab Invest 45: 400–409, 1981
29. Grond J, Schilthius M, Koudstaal J, Elema JD: Mesangial function and glomerular sclerosis in rats after unilateral nephrectomy. Kidney Int 22: 338–343, 1982
30. Rennke HG: Structural alterations associated with glomerular hyperfiltration. Contemp Issues Nephrol 14: 111–131, 1986
31. Hostetter TH, Troy JL, Brenner BM: Glomerular haemodynamics in experimental dialbetes mellitus. Kidney Int 19: 410–413, 1981
32. Rudberg S, Persson B, Dahlquist G: Increased glomerular filtration rate as a predictor of diabetic nephropathy –results from an 8–year prospective study. Kidney Int 41: 822–828, 1992
33. Yoshida Y, Fogo A, Ichikawa I: Glomerular hemodynamic changes vs. hypertrophy in experimental glomerular sclerosis. Kidney Int 35: 654–660, 1989
34. Daniel BS, Hostetter TH: Adverse effects of growth in the glomerular microcirculation. Am J Physiol 258: F1409–F1416, 1990
35. Fries JW, Sandstrom DJ, Meyer TW, Rennke HG: Glomerular hypertrophy and epithelial cell injury modulate progressive glomerulosclerosis in the rat. Lab Invest 60: 205–218, 1989
36. Deen WM, Robertson CR, and Brenner BM: A model of glomerular ultrafiltration in the rat. Am J Physiol 223: 1178–1183, 1972
37. Lemley KV, Blouch K, Abdullah I, Boothroyd DB, Bennett PH, Myers BD, Nelson RG: Glomerular permselectivity at the onset of nephropathy in type 2 diabetes mellitus. J Am Soc Nephrol 11:2095–2105, 2000
38. Hirakata M, Kaname S, Chung UG, Joki N, Hori Y, Noda M, Takuwa Y, Okazaki T, Fujita T, Katoh T, Kurokawa K: Tyrosine kinase dependent expression of TGF–beta induced by stretch on mesangial cells. Kidney Int 51: 1028–1036, 1997
39. Riser BL, Cortes P, Heilig C, Gordin J, Ladson–Wofford S, Patterson D, Narins RG: Cyclic stretching forces selectively upregulates TGF–beta isoforms in culltured rat mesangial cells. Am J Pathol 148: 1915–1923, 1996
40. Li Q, Muragaki Y, Hatamura I, Ueno H, Ooshima A: Stretchinduced collagen synthesis in cultured smooth muscle cells from rabbic aortic media and a possible involvement of angiotensin II and TGF–beta. J Vasc Res 35: 93–103, 1998
41. Scheng O, Ling H, Sebekova K, Vamvakas S, Heidland A: High glucose media enhance the responsiveness of tubular cells to growth promoters: Effect on lysosomial cathepsins and protein degradation. Mineral Electrolyte Metab 24: 254–260, 1998
42. Russo LM, Osicka TM, Bonnet F, Jerums G, Comper WD: Albuminuria in hypertension is linked to altered lysosomal activity and TGF–beta1 expression. Hypertension 39: 281–286, 2002
43. Steinberg HO, Chaker H, Leaming R, Johnson A, Brechtel J, Baron AD: Obesity/insulin resistance is associated with endothelial dysfunction: Implications for the syndrome of insulin resistance. J Clin Invest 97: 2601–2610, 1996
44. Arcaro G, Zamboni M, Rossi L, Turcato E, Covi G, Armellini F, Bosello O, Lechi A: Body fat distribution predicts the degree of endothelial cell dysfunction in uncomplicated obesity. Int J Obes 23: 936–942, 1999
45. Perticone F, Ceravolo R, Candigliota M, Ventura G, Iacopino S, Sinopoli F, Mattioli PL: Obesity and body fat distribution induce endothelial dysfunction by oxidative stress. Diabetes 50: 159–165, 2001
46. Suwaidi JA, Higano ST, Holmes DR, Lennon R, Lerman A: Obesity is independently associated with coronary endothelial dysfunction in patients with normal or mildly diseased coronary arteries. J Am Coll Cardiol 37: 1523–1528, 2001
47. Brook RD, Bard RL, Rubenfire M, Ridker P, Rajagopalan S: Usefulness of visceral obesity (waist/hip ratio) in predicting vascular endothelial function in healthy overweight adults. Am J Cardiol 88: 1264–1269, 2001
48. Suwaidi J, Hamasaki S, Higano ST, Nishimura RA, Holmes DR, Lerman A: Long–term follow–up of patients with mild coronary artery disease and endothelial dysfunction. Circulation 101:948–954, 2000
49. Schachinger V, Britten MB, Zeiher AM: Prognostic impact of coronary vasodilator dysfunction on adverse long–term outcome of coronary heart disease. Circulation 101: 1899–1906, 2000
50. Reisin E, Abel R, Modan M, Silverberg DS, Eliahou HE, Modan B: Effect of weight loss without salt restriction on the reduction of blood pressure in overweight hypertensive patients. N Engl J Med 298: 1–6, 1978
51. Hall, JE MW Brands, WN Dixon, and M.J: Smith Jr: Obesity induced hypertension. Renal function and systemic hemodynamics. Hypertension 22: 292–299, 1993
52. Hall JE: Renal and cardiovascular mechanisms of hypertension in obesity. Hypertension 23: 381–394, 1994
.
Особенности питания и риск сердечно-сосудистых заболеваний
Оценить влияние продуктов на риск сердечно-сосудистых заболеваний весьма непросто – ведь мы употребляем их не по отдельности, а вместе. Однако все научные исследования по этому вопросу сходятся в том, что наиболее эффективными являются т.н. «средиземноморская» диета и диета DASH для людей с повышенным давлением (от англ. DASH – Dietary Approaches to Stop Hypertension).
Остановимся подробнее на «средиземноморской» диете. Одна из важных ее особенностей – это употребление большого количества разнообразных овощей и фруктов, что обеспечивает поступление в организм разных микроэлементов, витаминов и антиоксидантов, в частности полифенолов.
Последние также содержатся в оливковом масле, красном вине, кофе, чае и какао. В последнее время появляются новые и новые данные об их полезных свойствах, в т.ч. при таких патологиях как субклиническое воспаление и эндотелиальная дисфункция.
Что касается рыбы, то можно и нужно включать в меню по крайней мере 2 порции в неделю – а также и другие пищевые источники омега-3 полиненасыщенных жирных кислот (орехи, сою и льняное масло) – это рекомендовано всем для первичной профилактики сердечно-сосудистых заболеваний.
Для этой диеты характерно минимальное потребление животных жиров; основной источник жира в рационе – это оливковое масло холодного отжима «extra virgin».
Употребление соли следует снизить до <5 г. в день – для этого нужно не только меньше солить готовую еду, но и ограничить продукты, законсервированные с добавлением соли. При наличии метаболического синдрома или артериальной гипертензии эти нормы еще строже.
Вино может употребляться в умеренном количестве вместе с пищей.
В целом средиземноморская диета может быть рекомендована как для первичной, так и для вторичной профилактики сердечных болезней.
В таблице 1 суммированы основные рекомендации по конкретным группам продуктов и способам их приготовления.
Таблица 1. Рекомендации по питанию для улучшения липидного профиля крови:
| Предпочтительно | Допустимо в умеренных количествах | Следует ограничить | |
| Злаки | Целнозерновые продукты | Хлеб из муки высшего сорта, белый рис, макароны, печенье, кукурузные хлопья | Сладкая выпечка (пирожные, кексы, круассаны, пирожки и пр.) |
| Овощи | Сырые и приготовленные овощи | Картофель | Овощи, приготовленные со сливочным маслом, сливочным соусом |
| Бобовые | Чечевица, бобы, фасоль, горох, нут, соевые бобы | ||
| Фрукты | Свежие и замороженные фрукты | Сухофрукты, варенье, консервированные фрукты, сорбеты, фруктовый лёд и сок | |
| Сладости и подсластители | Некалорийные подсластители | Сахар, мёд, шоколад, конфеты | Торты и сладкая выпечка, мороженое, фруктоза, сладкие прохладительные напитки |
| Мясо и рыба | Жирные и нежирные сорта рыбы, мясо птицы без кожи | Постные куски говядины, баранины, свинины, телятины, морепродукты | Сосиски, колбаса, бекон, грудинка, хот-доги, субпродукты |
| Молочные продукты и яйца | Обезжиренное молоко, обезжиренный йогурт | Молоко, сыр, и другие молочные продукты низкой жирности, яйца | Сыр, сливки, цельное молоко, йогурт |
| Жиры, приправы, соусы, заправки | Уксус, горчица, нежирные заправки | Оливковое масло, растительные масла, мягкий маргарин, заправки для салатов, майонез, кетчуп | Транс-жиры и твёрдый маргарин (лучше вообще исключить), пальмовое и кокосовое масла, сливочное масло, сало, беконный жир |
| Орехи/семена | Всё, кроме кокосового ореха, без соли | Кокосовый орех | |
| Технологии приготовления | Гриль, отваривание, приготовление на пару | Стир-фрай (быстрое обжаривание в воке), запекание | Жарка |
Патофизиологические механизмы развития аг у пациентов с ожирением
Во многих исследованиях показано, что ожирение тесно коррелирует с АД и считается одним из ведущих факторов риска развития АГ [6, 7]. У тучных пациентов риск развития АГ в 2–3 раза превышает таковой у пациентов с нормальной массой тела [8]. Средние показатели систолического (САД) и диастолического (ДАД)
АД у пациентов с ожирением превышают показатели АД у пациентов c нормальной массой тела на 9 и 7 мм рт. ст. у мужчин и на 11 и 6 мм рт. ст. – у женщин [9]. Даже у детей наличие ожирения, согласно канадским наблюдениям, в 7 раз повышает риск развития АГ [10].
Отличительной чертой первичного ожирения является чрезмерное отложение жира в организме. Первичное ожирение является следствием нарушения взаимодействий адипоцитов и гипоталамуса, по этой причине изменяется пищевое поведение больного; кроме того, дополнительное снижение физической активности усугубляет проблему.
Многими авторами первичное ожирение характеризуется как алиментарно-конституционально-гиподинамическое. Главная отличительная черта первичного ожирения – это относительная (80%) или абсолютная (20%) лептинорезистентность с гиперлептинемией и, часто, гиперинсулинемией.
Жировая ткань состоит из зрелых адипоцитов, преадипоцитов, эндотелиальных клеток и макрофагов и на сегодняшний день рассматривается не как пассивное хранилище триглицеридов, а как самостоятельный эндокринный и паракринный орган [11, 12]. Адипоциты – функциональные единицы жировой ткани, способные синтезировать и секретировать в кровоток различные биологически активные соединения пептидной и непептидной природы.
Ожирение, связанное с АГ, некоторыми экспертами признается как отдельный фенотип, требующий тщательного подхода к диагностике, лечению и профилактике.
Ведущими механизмами развития АГ при ожирении являются активация симпатоадреналовой (САС) и ренин-ангиотензин-альдостероновой (РААС) систем [13].
Нейрогенный характер АГ при ожирении подтверждается повышением активности симпатической нервной системы (СНС) в сосудах почек и скелетной мускулатуры [14]. В исследовании NAS (Normotensive Aging Study) было обнаружено повышение уровня норадреналина в моче, пропорциональное ИМТ [15].
При снижении веса активность СНС уменьшается [16, 17]. Выраженное влияние на АД оказывают вегетативный дисбаланс и психоэмоциональный стресс, что проявляется в нарушении циркадного профиля, преимущественно САД. Чем больше вес, тем больше выражены колебания САД.
Возникновение АГ при ожирении связывают с ростом активности центральных отделов регуляции СНС под воздействием гиперинсулинемии и ИР. Инсулин может повышать активность САС сам по себе, но отчасти это может быть связано с действием лептина. Известно, что по мере увеличения степени ожирения тощаковый уровень лептина, который секретируется адипоцитами, растет.
Установлено наличие взаимосвязи между РААС и CНC. С активацией СНС связывают усиление секреции ренина в почках, и происходит это независимо от внутрипочечной сенсорной системы, регулирующей секрецию ренина почками. Более того, увеличение циклического аденозинмонофосфата под влиянием катехоламинов стимулирует экспрессию ангиотензиногена (АТ) в адипоцитах человека [20]. Таким образом, нарушение регуляции САС при ожирении также способно стимулировать активность РААС.
Гиперактивация РААС – один из ключевых механизмов развития АГ при ожирении. Исследования на животных показывают, что жировая ткань является дополнительным важным источником АТ, ангиотензинпревращающего фермента и ренина, и при наличии ожирения доля компонентов РААС, вырабатывающихся в жировой ткани, среди циркулирующих уровней этих компонентов становится весьма значимой [21].
Активность тканевой РААС тесно связана с продукцией адипокинов жировой тканью. Показано, например, что АТ II вызывает экспрессию лептина в адипоцитах [22]. Было высказано предположение, что такая активность свойственна только локально синтезируемому АТ II в отличие от системного АТ II [23].
Широко известно, что висцеральная жировая ткань вырабатывает большое количество биологически активных пептидов, многие из которых оказывают негативное влияние на развитие и прогрессирование АГ.
Самый известный гормон жировой ткани – лептин, он участвует в регуляции аппетита, активируя центр насыщения. Циркулирующие уровни лептина коррелируют с наличием и степенью ожирения и повышены у тучных людей. Оказывается, что у пациентов с избыточной массой тела развивается резистентность к лептину, и, несмотря на его высокую концентрацию в плазме, аппетит не подавляется.
Была обнаружена взаимосвязь между уровнем лептина и развитием АГ. Научные данные свидетельствуют о нескольких механизмах развития АГ при повышении уровня лептина. Во-первых, лептин изменяет активность почечной Na-, K-АТФ-азы, которая отвечает за уровень натрия [24].
Во-вторых, лептин активирует РААС. Также выявлена способность ренина к повышению активности СНС. Симпатическая стимуляция локальной почечной РААС, в свою очередь, ведет к повышению секреции АТ II, альдостерона, задержке воды и натрия в организме и, как следствие, к повышению АД.
Дополнительный вклад в развитие АГ, опосредованной лептином, заключается в его способности к потенцированию прессорного эффекта норадреналина [25]. В-третьих, высокие уровни лептина связаны с резистентностью к инсулину, что тоже может быть одним из механизмов развития и прогрессирования гипертензии [26].
Ведутся активный научный поиск молекулярных механизмов биосинтеза адипопродуцируемых гормонов, определение их роли в развитии ожирения, ИР и связанных с ними кардиоваскулярных заболеваний. Выявлено, что избыток висцеральной жировой клетчатки приводит к увеличению содержания гормонов, усиливающих проявление ИР (резистин, фактор некроза опухолей-α (ФНО-α), ингибитор активатора плазминогена–1 (ИАП-1)

В дополнение к эффектам лептина гиперпродукция провоспалительных адипокинов ИЛ-6, ФНО-α, ИАП-1 и С-реактивного белка способствует развитию и поддержанию системного воспалительного ответа и окислительного стресса [29]. Наоборот, адипонектин является важным стимулятором NO-синтазы и дополнительно обеспечивает защиту от окислительного стресса и резистентности к инсулину. Снижение уровня циркулирующего адипонектина при ожирении связано с подавлением его синтеза провоспалительными адипокинами.
Все вышеперечисленные метаболические нарушения не только увеличивают риски развития ССЗ, но и, вызывая резистентность к инсулину, способствуют развитию СД 2-го типа. Следует отметить, что гиперинсулинемия и ИР при ожирении могут вызывать АГ посредством не только гиперстимуляции САС, но и через реализацию антинатрийуретического эффекта [30].
Есть и другие механизмы, посредством которых ожирение может способствовать развитию АГ. Например, апноэ сна – частое осложнение ожирения, может вызвать изменения в гипоталамо-гипофизарно-надпочечниковой системе, повышение уровня кортизола, а также дополнительную активацию СНС (рис. 1).







