Коррекция метаболических нарушений при висцеральном ожирении метформином (багомет)
Чрезвычайно актуальной проблемой современной медицины является метаболический синдром (МС). МС представляет собой совокупность гормональных и метаболических нарушений, взаимосвязанных факторов риска развития сердечно–сосудистых заболеваний и сахарного диабета (СД), которые объединяет общий патофизиологический механизм – инсулинорезистентность (ИР). Острота данной проблемы в здравоохранении различных стран обусловлена высокой распространенностью МС, увеличивающейся с возрастом и составляющей 14–24% в общей популяции [2,8,29]. Частота МС с некоторым отставанием параллельна распространенности ожирения в популяции [31]. В то же время значительный процент распространенности МС, по сравнению с общей популяцией, наблюдается в некоторых этнических группах (латиноамериканцы и выходцы из индийского субконтинента). К сожалению, в последнее время наблюдается четкая тенденция к росту числа пациентов с МС среди подростков и молодежи [23,28]. Столь серьезное внимание, которое уделяется этой проблеме, обусловлено высокой степенью риска развития и прогрессирования сердечно–сосудистых заболеваний, связанных с атеросклерозом и сахарным диабетом 2 типа (СД 2), а также повышением риска коронарных осложнений и общей смертности [8,18,22]. В настоящее время МС включает следующие компоненты: абдоминально–висцеральное ожирение, ИР и гиперинсулинемию, нарушение толерантности к глюкозе, дислипидемию, артериальную гипертензию, микроальбуминурию, нарушение системы гемостаза, ранний атеросклероз [1,2,22]. Кроме того, МС часто сопутствуют синдром ночного апноэ, эндотелиальная дисфункция, нарушения пуринового обмена, недостаточное снижение артериального давления (АД) в ночное время и гепатостеатоз [9,12].
Согласно критериям, которые были разработаны комитетом экспертов Национальной образовательной программы по холестерину (ATPIII, 2001 г.), диагноз МС устанавливается, если у пациента обнаруживается три и более из следующих признаков [30]:
• абдоминальное ожирение (ОТ>102 см у мужчин, ОТ>88 у женщин);
• уровень триглицеридов >1,7 ммоль/л (>150 мг/дл);
• ХС ЛПВП <1 ммоль/л (<40 мг/дл) у мужчин, <1,3 ммоль/л (< 50 мг/дл) у женщин;
• Артериальная гипертензия (АД>130/85 мм рт.ст.);
• показатели глюкозы натощак >6,1 ммоль/л (>110 мг/дл).
Новая редакция определения МС у лиц белой расы была представлена Международной Федерацией диабета в 2005 году [31] (табл. 1).
Однако следует обратить внимание, что человек может иметь МС и при незначительном избытке массы тела (или при его отсутствии) в случае обнаружения 3 других компонентов синдрома. Практически все компоненты, составляющие МС, являются клинически значимыми факторами риска развития сердечно–сосудистых заболеваний, а сочетание нескольких компонентов существенно увеличивает опасность их развития [1,17]. Так, результаты исследования BOTNIA, включившего 4483 пациента, показали, что, вероятность развития ИБС и инсульта у лиц с МС в 3–3,5 раза выше. Кроме того, пациенты с МС умирают в четыре раза чаще, а при наличии сердечно–сосудистых заболеваний – в 5,5 раз чаще по сравнению с пациентами, не имеющими данного синдрома [9].
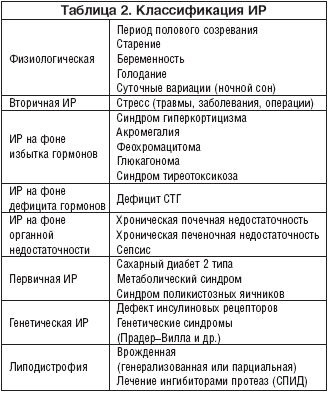
Патофизиологическим звеном, объединяющим комплекс различных нарушений, развивающихся на фоне МС, является резистентность к инсулину. Степень ИР зависит от ряда факторов, включая генетические особенности организма, условия внутриутробного развития и средовые воздействия [8,23]. К факторам внешней среды, способствующим возникновению МС, относят высококалорийное питание атерогенного характера, избыточную массу тела, стрессы, вредные привычки. Недостаточная физическая активность способствует развитию ожирения и снижает чувствительность скелетных мышц к инсулину. В последние годы получены новые данные о механизмах ИР и ее роли в развитии многочисленных гормонально–метаболических нарушений, характерных для данного синдрома. ИР может быть как генетически детерминированной, так и приобретенной. В настоящее время известно более 40 различных состояний и заболеваний, при которых развивается ИР (табл. 2). Наряду с этим физиологическая ИР характерна для пубертатного периода, беременности и пожилого возраста.
Изучение генетических факторов показало, что ИР – это полигенная патология, для развития которой могут иметь значение мутации генов субстрата инсулинового рецептора (IRS–1 и IRS–2), гликогенсинтетазы, гексокиназы II, b3–адренорецепторов, разобщающего протеина (UCP–1), а также молекулярные дефекты белков сигнального пути инсулина (внутриклеточные транспортеры глюкозы), белков, связывающих жирные кислоты (FABP–II) [18].
Известно, что чувствительность тканей к инсулину снижается более чем на 40% при превышении идеального веса на 35–40%. Вместе с тем ИР определяется характером распределения жировой ткани в организме. Важную роль в развитии и прогрессировании ИР играет именно висцеральная жировая ткань, составляющая около 6–20% общей массы тела. Адипоциты висцерального, в отличие от подкожного жира, имеют высокую плотность и чувствительность b–адренорецепторов, кортизола, а также низкую плотность и чувствительность инсулиновых рецепторов [1,13]. Описанные метаболические признаки определяют повышенную чувствительность висцеральных адипоцитов к липолитическим воздействиям, и наоборот, низкую – к антилиполитическому эффекту инсулина. Кроме того, цитокины, секретируемые висцеральными адипоцитами, вследствие анатомо–топографических особенностей поступают преимущественно в портальную систему. В отличие от этого, адипоцитокины из подкожных жировых депо поступают сразу в системный кровоток. Следовательно, висцеральная жировая ткань оказывает значительное влияние на метаболические процессы, происходящие в печени. Однако точные механизмы, лежащие в основе взаимосвязи между висцеро–абдоминальным ожирением и МС, окончательно не ясны, и, вероятно, сложны.
Интенсивный липолиз в условиях избыточного отложения висцерального, интраабдоминального жира приводит к повышенной мобилизации свободных жирных кислот (СЖК) из жировой ткани, концентрация которых может в 20–30 раз превышать их концентрацию, наблюдаемую при отсутствии висцерального ожирения [7,13]. СЖК являются важной детерминантой развития многочисленных метаболических нарушений. Поступая через систему воротной вены в печень, СЖК используются печенью как субстраты для образования ТГ, что объясняет гипертриглицеридемию – характерный признак МС. Кроме того, повышенные концентрации СЖК усугубляют периферическую ИР, а компенсаторная гиперинсулинемия (ГИ) способствует еще большему увеличению массы тела больных МС. Известно, что повышение уровня СЖК ведет к подавлению процессов транспорта и фосфорилирования глюкозы и, как следствие, к снижению окисления глюкозы и синтеза гликогена в мышцах. Уменьшение чувствительности печени к действию инсулина также ведет к снижению синтеза гликогена, усилению гликогенолиза и глюконеогенеза.
В условиях ИР и ГИ формируется атерогенная дислипидемия, характеризующаяся гипертриглицеридемией, повышением содержания ХС ЛПНП, снижением концентрации ХС ЛПВП [19]. Известно, что гипертриглицеридемия в сочетании с низким уровнем ХС ЛПВП является независимым и существенным фактором риска инфаркта миокарда/инсульта у больных МС. Изменения липидных параметров имеют не только количественный, но и качественный характер. Так, нередко при нормальной концентрации ХС ЛПНП у больных с МС эти липопротеиды имеют меньший размер, большую плотность, легче подвергаются перекисному окислению и мигрируют в субэндотелиальное пространство, инициируя быстрое образование атеросклеротической бляшки.
Проблема лечения МС по–прежнему остается в центре внимания практических врачей. Основная цель терапии больных с МС – максимальное снижение риска развития сердечно–сосудистых заболеваний и их осложнений. Лечение МС включает изменение образа жизни и диетические рекомендации: снижение калорийности рациона, полное исключение алкоголя, ограничение жиров животного происхождения и холестерина (менее 300 мг/сут.), употребление полиненасыщенных жирных кислот (в частности, морской рыбы), активную физическую нагрузку (4–5 занятий в неделю по 30 минут в день при отсутствии клинических признаков ИБС).
Согласно современным рекомендациям, начальное снижение массы тела у пациентов с МС должно составлять не менее 10% от исходной массы [1]. Снижение массы тела позволяет уменьшить ИР, а также получить положительный эффект в отношении артериальной гипертензии и показателей липидного спектра крови.
Важным направлением фармакотерапии является коррекция ИР – ключевого звена МС. В настоящее время одним из препаратов первого выбора фармакотерапии МС является метформин. Согласно рекомендациям Международной Федерации диабета (2005), метформин рекомендуется в качестве препарата первого ряда для пациентов с СД 2 [31]. Метформин – препарат, относящийся к группе бигуанидов, повышает печеночную и периферическую чувствительность к эндогенному инсулину, не влияя на его секрецию [13,17]. Фармакологические эффекты метформина – это результат воздействия препарата на чувствительность к инсулину на уровне печени, мышечной и жировой тканей. Хотя преобладающим является влияние метформина на продукцию глюкозы печенью, именно комбинация его эффектов на уровне всех трех тканей, по–видимому, обусловливает благоприятный фармакологический профиль препарата.
Основным механизмом действия метформина является снижение продукции глюкозы печенью [14]. Такой механизм действия препарата в основном связан с подавлением процессов глюконеогенеза и в меньшей степени гликогенолиза.
Наряду с этим, под влиянием метформина улучшается чувствительность к инсулину скелетных мышц и жировой ткани, что реализуется посредством ряда клеточных механизмов [15,21]. Усиливая кровообращение в печени и ускоряя процесс превращения глюкозы в гликоген, метформин увеличивает синтез гликогена в печени [14].
Препарат замедляет процессы всасывания углеводов в желудочно–кишечном тракте, а также обладает анорексигенными свойствами [14,22]. Полагают, что один из механизмов анорексигенного действия метформина связан с его влиянием на метаболизм глюкогоноподобного пептида–1 (ГПП–1). Так, в работе Mannucci E. и соавт. определяли уровни ГПП–1 (7–36)амида/(7–37) исходно и через 15 дней терапии метформином (2550 мг/сут.) у больных с ожирением до и после нагрузки ГТТ [20]. С целью устранения влияния инсулинемии и гликемии на секрецию ГПП–1 исследование проводилось в условиях эугликемического гиперинсулинемического клэмпа. Авторы не обнаружили изменений концентраций ГПП–1 у лиц контрольной группы. Вместе с тем у больных с ожирением метформин вызывал существенное увеличение концентрации ГПП–1 (7–36)амида/(7–37) на 30 и 60 минутах теста при неизмененном базальном уровне пептида. В смешанной плазме (после 30 мин. инкубации при 37°С), а также в растворе буфера, содержащем дипептидил–пептидазу–4, метформин ингибировал деградацию ГПП–1.
Важным эффектом метформина является уменьшение или стабилизация массы тела, а также снижение отложения висцерального жира. Согласно результатам экспериментальных исследований на животных моделях, анорексигенный эффект метформина, по–видимому, связан с центральным действием препарата на уровне гипоталамических нейронов [4]. Модулируя экспрессию орексигенного нейропептида Y, метформин способствует снижению массы тела. В различных исследованиях установлено, что в зависимости от длительности приема метформина снижение массы тела у больных с МС составило от 0,5 до 4,5 кг [4,5,22]. В работе Kurukulasusuriya R. и соавт. показано, что количество висцерального жира на фоне терапии метформином снизилось на 15,5%, в то время как изменение общей массы подкожного жира в конце исследования было недостоверно [16]. Опубликованные данные по применению метформина у подростков с МС в течение 6 месяцев показали, что применение метформина сопровождалось снижением индекса массы тела (ИМТ), объема талии, количества висцеральной жировой ткани (см2), концентрации инсулина натощак [28].
Наряду с этим, метформин обладает и рядом других метаболических и гемодинамических эффектов, позволяющих позитивно воздействовать на различные компоненты МС. Лечение метформином сопровождается снижением концентрации триглицеридов на 10–20%, ХС ЛПНП – на 10% и, как следствие, снижением печеночного синтеза и повышением клиренса ЛПОНП, повышением концентрации ХС ЛПВП на 10–20% [5,6,22]. Многие из этих эффектов метформина обусловлены уменьшением ИР. Снижение поступления СЖК в печень и концентрации ТГ под влиянием метформина в условиях улучшения чувствительности к инсулину приводят к уменьшению явлений гепатостеатоза – известного компонента МС [13,15].
Повышая печеночную и периферическую чувствительность к эндогенному инсулину, метформин напрямую не влияет на секрецию инсулина. Не оказывая прямых эффектов на b–клетки, метформин опосредованно улучшает секрецию инсулина, способствует сохранению функциональной активности b–клеток, снижая глюкозотоксичность и липотоксичность [22,26,34]. При этом на фоне уменьшения ИР снижается базальный уровень инсулина в сыворотке крови [28].
Кроме того, у больных МС метформин оказывает кардиоваскулярные протективные эффекты [32]. Так, метформин положительно влияет на систему гемостаза и реологию крови, обладает способностью не только тормозить агрегацию тромбоцитов, но и снижать риск образования тромбов [15]. Кроме того, метформин оказывает антиоксидантное влияние на тромбоциты, снижает уровень тромбоцитарного фактора 4 и b–тромбоглобулина, являющихся маркерами активации тромбоцитов [11]. Недавние исследования показали улучшение процессов фибринолиза под влиянием терапии метформином, что обусловлено снижением уровня ИАП–1, инактивирующего тканевой активатор плазминогена [5,26]. Важно отметить, что in vitro метформин тормозит включение липидов в сосудистую стенку, пролиферацию гладкомышечных клеток сосудов [3,12,19]. Влияя на процессы полимеризации и агрегации фибрина, метформин вызывает нарушение структуры и функции фибрина.
Вазопротективные эффекты метформина заключаются в нормализации цикла сокращения/расслабления артериол, уменьшении проницаемости сосудистой стенки и торможении процессов неоангиогенеза, восстановлении функции пейсмекерных клеток, регулирующих циклическую вазодвигательную активность [12,15]. На фоне терапии метформином повышается транспорт глюкозы в эндотелии и гладких мышцах сосудов, а также в мышце сердца, улучшается эндотелий – зависимая вазодилатация [21,32].
В наши дни большое внимание уделяется активной профилактике СД 2 [1,22,34]. Согласно мнению Laaksonen D.F. и соавт., риск развития СД 2 у пациентов с МС повышается в 7–9 раз, по сравнению с индивидами, не имеющими МС [17]. В настоящее время в мире насчитывается свыше 300 миллионов людей с НТГ [33]. Согласно эпидемиологическим прогнозам, к 2025 г. число пациентов с НТГ повысится до 500 миллионов. Ежегодно примерно у 1,5–7,3% лиц с НТГ развивается СД 2. В крупнейшем исследовании DPP (Diabetes Prevention Program, 2002) было показано, что терапия метформином может эффективно и безопасно предотвращать развитие СД 2 у пациентов с НТГ, особенно у пациентов с ИМТ более 25 кг/м2 и имеющих высокий риск развития СД 2 [8].
За долгие годы применения в клинической практике метформин, являющийся диметилбигуанидом и абсорбирующийся в основном в тонком кишечнике, продемонстрировал высокую безопасность. Метформин практически не метаболизируется в организме и полностью выводится почками в неизмененном виде (период полувыведения – 1,5–4,9 час.).
В последнее время появился препарат метформина Багомет 850 в виде таблетки на основе «гидрофильной матрицы». Таблетка отформована на основе гипромеллозы («искусственная слеза»), между нитями которой диффузно расположены гранулы метформина. Через несколько часов после попадания в жидкую среду верхний гидрофильный слой приобретает гелеобразный вид, волокна гипромеллозы постепенно «расплетаются», освобождая гранулы метформина, который постепенно, слой за слоем, растворяется в кишечном содержимом. Подобная разработка позволяет получить длительное, стабильное, отличающееся отсутствием «пиков» действие метформина. Препарат имеет продолжительное – 12–часовое действие и полностью перекрывает ночной пик гепатической продукции глюкозы. Удобство применения препарата повышает приверженность пациентов лечению.
Противопоказаниями к назначению метформина являются нарушения функций почек (снижение клиренса креатинина ниже 50 мл/мин. или концентрация креатинина крови более 132 ммоль/л у мужчин и более 123 ммоль/л у женщин), гипоксические состояния любой природы, а также злоупотребление алкоголем. Следует воздержаться от назначения препарата в период беременности и лактации [14].
Лечение препаратом инициируют с 500–850 мг, принимаемых во время ужина или на ночь. В дальнейшем доза препарата увеличивается на 500–850 мг каждые 1–2 недели. Максимальная рекомендованная доза у больных с МС составляет 1500–1700 мг в сутки в режиме 2–3 приемов. Во избежание побочных явлений метформина (диарея, метеоризм, абдоминальный дискомфорт, металлический вкус во рту) необходима постепенная титрация дозы препарата.
В заключение следует отметить, что в настоящее время рациональная терапия МС метформином, обладающим благоприятным спектром фармакологических эффектов, в сочетании с нефармакологическими методами является эффективным способом коррекции ИР и позволяет существенно повлиять на качество жизни пациентов и предотвратить возникновение опасных для жизни сердечно–сосудистых осложнений.

Литература
1. Aronne L.J., Segal R.K. Adiposity and fat distribution outcome measures:assessment and clinical implications // Obes Res–2002; 10(1): 14S–21S.
2. Bosello O., Zamboni M. Visceral obesity and metabolic syndrome// Obes. Rev.–2000, 1, 47–56
3. Bradley J. D., Zhonglin X., Benoit V., and Ming–Hui Z. Activation of the AMP–Activated Kinase by Antidiabetes Drug Metformin Stimulates Nitric Oxide Synthesis In Vivo by Promoting the Association of Heat Shock Protein 90 and Endothelial Nitric Oxide Synthase.// Diabetes.–2005 55: 496–505
4. Chau–Van C., Gamba M., Salvi R. et al. Metformin Inhibits Adenosine 5’–Monophosphate–Activated Kinase Activation and Prevents Increases in Neuropeptide Y Expression in Cultured Hypothalamic Neurons. // Endocrinology.– 2007; 148(2): 507 – 511.
5. Charles M.A., Morange P., Eschwege E. et al. Effects of weight change and metformin on fibrolysis and the von Willebrand factor in obese nondiabetic subjects. The BIGPRO1 Study.// Diabetes Care–1998; 21:1967–75
6. Charles M.A., Eschwege E., Grandmottet and al. Treatment with metformin of non–diabetic men with hypertension. Hypertriglyceridemia and central fat distribution: the BIGPRO 1.2 trial. // Diabetes Metab Res Rev.– 2000; 16: 2–7
7. Dagher Z., Ruderman N., Tornheim K., Ido Y.: Acute regulation of fatty acid oxidation and AMP–activated protein kinase in human umbilical vein endotehlial cells.// Circ Res.–2001; 88 :1276 –1282
8. Diabetes Prevention Program Research Group/ Reduction in the incidence of type 2 diabetes with lifesyill intervention or metformin. // N Engl J Med.–2002; 346, 393–403
9. Isomaa, B., Lahti, K., Almengren P. et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome.// Diabetes Care 24 (2001), 683–689.
10. Ford E.S., Giles W.H., Dietz W.H. Prevalence of the metabolic syndrome among U.S. adults: findings from the third National Health and Nutrition Examination Survey.// JAMA.– 2002;287:356–359
11. Grand P.J. Beneficial effects of metformin on hemostasis and vascular function in man.. // Diabetes Meteb.–2003, 29/6S45–52
12. Jadhav S., Ferrell W., Greer I. A. et al. Effects of Metformin on Microvascular Function and Exercise Tolerance in Women With Angina and Normal Coronary Arteries: Randomized, Double–Blind, Placebo– Controlled Study// J. Am. Coll. Cardiol.– 2006; 48(5): 956 – 963.
13. Kahn BB, Flier JS: Obesity and insulin resistance.// J Clin Invest –2000;106:473–81
14. Kirpichnikov D., McFarlane S.I., Sowers J.R, Metformin:An Update //Ann Intern Med.– 2002; 137: 25 –33
15. Klip A., Leiter L.A Cellular mechanism of action of metformin // Diabetes Care.– 1990; 13 (6): 696–704
16. Kurukulasusuriya R., Banerij M.A., Chaiken R., Lebovitz H. Selective decrease in visceral fat is associated with weight loss during metformin treatment in African Americans with type 2 diabetes (abstract)/ //Diabetes.–1999, 48, A315.
17. Laaksonen D.F., Laaka H.M., Niskanen L.K. et al Metabolic syndrome and development of diabetes mellitus: application and validation of recently suggested definition of the metabolic syndrome in a prospective cohort stady. // Am J Epidemiol. –2002; 156, 1070–7.
18. McFarlane S.I., Banerij M., Sowers J.R. Insulin resistance and cardiovascular disease. //J Clin Endocrinol Metab. – 2001; 86: 713–8
19. Mamputu J.C., Wiernsperger N.F., Renier G. A. Antiatherogenic properties of metformin: the experimental evidence. // Diabetes Meteb.–2003, 29/6S71–6
20. Mannucci E., Ognibene A.,, Cremasco F. et al Effect of Metformin on Glucagon–Like Peptide 1 (GLP–1) and Leptin Levels in Obese Nondiabetic Subjects. // Diabetes Care– 2001; 24 (3): 489–494
21. Matthaei S., Hamann A., Klein H.H., Benecke H. et al. Association of Metformin’s effect to increase insulin–stimulated glucose transport with potentiation of insulin–induced translocation of glucose transporters from intracellular pool to plasma membrane in rat adipocytes // Diabetes. –1999; 40(7): 850–857
22. Matthaei S., Stumvoll M., Kellerer M., H?ring H.–U. Pathophysiology and pharmacological treatment of insulin resistance// Endocr. Rev.– 2000; 21(6): 585 – 618
23. Miller J, Rosenbloom A, Silverstein J: Childhood obesity.// J Clin Endocrinol Metabol –2004;89–9:4211–18
24. Ming–Hui Z., Kirkpatrick S.S., Davis B.J.et al. Activation of the AMP–activated protein kinase by the anti–diabetic drug metformin in vivo: role of mitochondrial reactive nitrogen species. //J Biol Chem.–2004279 :43940 –51
25. Nagi D.K., Yudkin J.S. Effects of metformin on insulin resistance, risk factors for cardiovascular disease, and plasminogen activator inhibitor in NIDDM subjects. A study of two ethnic groups // Diabetes Care. – 1993; 16 (4): 621–629.
26. Patane G., Piro S., Rabuazzo A.M., Anello M. et al. Metformin restores insulin secretion altered by chronic exposure to free fatty acids or high glucose: a direct metformin effect on pancreatic beta–cells // Diabetes. –2001; 49(5): 735–740
27. Piatti P.M., Monti L.D., Galli l. Et al. Relationship betweem endotelin–1 concentration and metabolic alteration typical of the insulin resistance syndrom. // Metabolism.–2000, 49,748–52.
28. Srinivasan S., Ambler G. R., Baur L. A. Randomized, Controlled Trial of Metformin for Obesity and Insulin Resistance in Children and Adolescents: Improvement in Body Composition and Fasting Insulin.// J. Clin. Endocrinol. Metab.–2006; 91(6): 2074 – 2080.
29. Steinberg HO, Baron AD: Vascular function, insulin resistance and fatty acids.// Diabetologia–2002; 45:623–4
30. Third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (Adult Treatment Panel III). NIH Publication 2001; 5. N 01–3670.
31. The IDF concensus worldwide definition of the metabolic syndrome. Availeble from: http://www.idf.org
32. Vitale C., Mercuro G., Cornoldi A. et al. Metformin improves endothelial function in patients with metabolic syndrome.// J Intern Med.–2005; 258 :250 –6
33. Zimmet P. The burden of type 2 diabetes: are we doing enough? // Diabetes Metabolism.– 2003; 29: 6S9–6S18.
34. Zimmet P., Shaw J., Alberti G. Preventing type 2 diabetes and the dysmetabolic syndrome in the real world: a realistic view. Diabetic medicine // 2003.– 20(9): 693–702.
.







