Вступление
Антибиотики поистине являются чудом. Они вывели медицину на новый уровень и спасли бесчисленное количество жизней. Однако с большим сожалением вынужден констатировать, что «успех» антибиотиков, возможно, временное явление. Сегодня перед человечеством стоит сложная долгосрочная задача: отыскать новые и совершенствовать уже имеющиеся методы борьбы с устойчивыми к антибиотикам бактериями.
Бактерии представляют собой отдельный домен жизни. Они радикально отличаются от нас — эукариот (и не только отсутствием оформленного клеточного ядра). Большинство процессов, связанных с репликацией ДНК, синтезом белка, а также основной метаболизм бактерий, их мембрана и клеточная стенка имеют свои особенности, отличающиеся от таковых у эукариот.
Основная классификация антибактериальных препаратов строится на их механизме действия и химической структуре. Поэтому дальше мы рассмотрим основные классы и механизмы действия антибиотиков, использующихся во врачебной практике. Однако прежде чем говорить об антибактериальных препаратах, нужно разобрать строение одной из самых главных и «излюбленных» их мишеней — клеточной стенки.
Клетка любого организма — будь то растение, грибы, археи, бактерии или животные, — имеет цитоплазматическую (клеточную) мембрану. Она состоит из двух слоев липидов, в которых «плавают» молекулы белков. Исходя из названия, несложно догадаться, что основным ее предназначением является отделение цитоплазмы и ее компонентов от внешней среды.
Конечно, у нее еще множество различных функций и особенностей строения, о которых более подробно вы можете узнать из статьи «Липидный фундамент жизни» [1]. Очень важно, что цитоплазматическая мембрана некоторых клеток (в первую очередь, конечно, бактериальных) может иметь некоторые «надстройки», главной из которых является клеточная стенка (рис. 1).
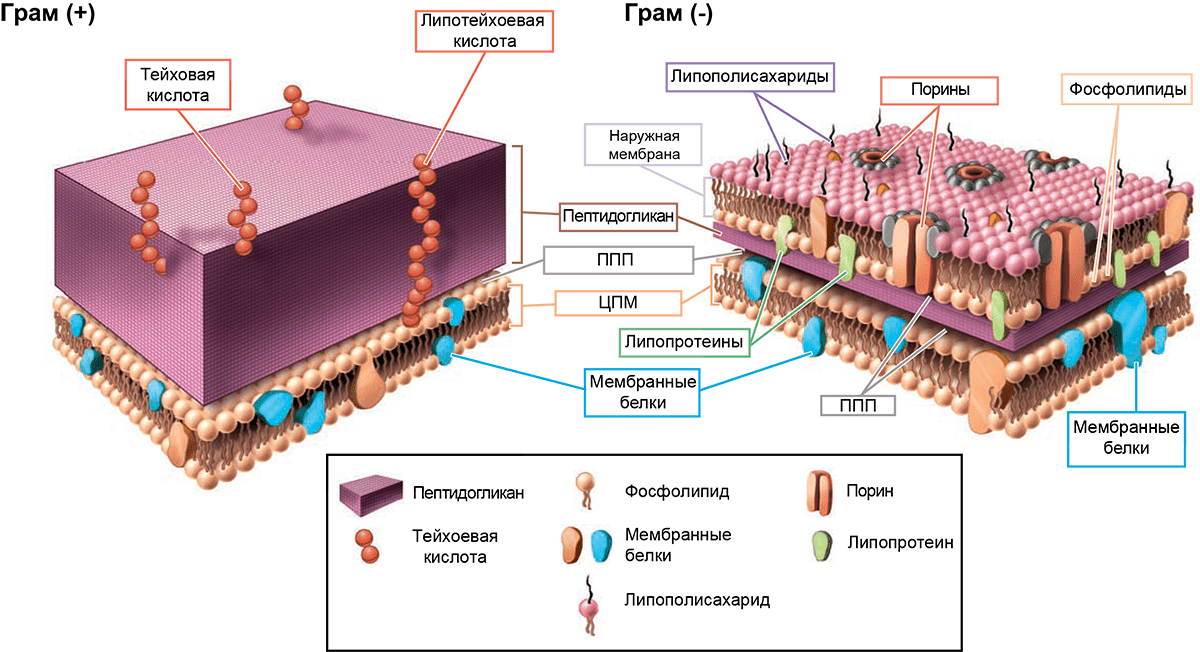
Рисунок 1. Строение клеточной стенки и мембран грамположительных (Г ) и грамотрицательных (Г−) бактерий. Основа любой бактериальной клетки — цитоплазматическая мембрана (ЦПМ), состоящая преимущественно из фосфолипидов и белков, «встроенных» в нее. На поверхности пептидогликана Г бактерий выступают тейхоевые кислоты — полимеры, состоящие из повторяющихся остатков (гликозил)полиолов, связанных фосфодиэфирными связями. Если они дополнительно соединены с липидами ЦПМ, их называют липотейхоевыми кислотами. «Барьеры» Г− микрорганизмов устроены немного сложнее. Их пептидогликановый слой намного тоньше, но зато он дополнительно защищен наружной мембраной, которая весьма богата на различные компоненты. Липополисахариды (ЛПС) состоят из трех различных компонентов: липида А, который «заякоривает» молекулу ЛПС в мембране, полисахаридного ядра, соединяющего липид А с последней составляющей ЛПС — антигеном O. Порины регулируют проницаемость наружной мембраны в ответ на изменение условий окружающей среды, а липопротеины «сшивают» наружную мембрану и клеточную стенку. Периплазматические белки, входящие в периплазматическое пространство (ППП), представлены в основном двумя типами: транспортными белками и гидролитическими ферментами. Если с предназначением первых все более-менее ясно, то одна из функций вторых (забегая вперед!) — обеспечивать инактивацию некоторых антибактериальных препаратов.
[2], иллюстрация адаптирована
Сразу оговорюсь, что существует классификация микроорганизмов, основанная на особенностях строения клеточной стенки (см. врезку). Главный ее компонент — пептидогликан (его также называют муреином) (рис. 2а); будет важно отметить, что он присущ только бактериям, в то время как, например, основной частью клеточной стенки грибов является хитин, а растений — целлюлоза (у клеток животных клеточная стенка вообще отсутствует!).
Наружная мембрана Г− бактерий представляет собой билипидный слой. На ее поверхности находятся липополисахариды (ЛПС), защищающие мембрану от агрессивных воздействий окружающей среды. Отрицательный заряд ЛПС повышает общий отрицательный заряд микроорганизма и стабилизирует его мембрану.
Данная структура (как и тейхоевые кислоты у грамположительных бактерий) может распознаваться иммунной системой нашего организма, которая обеспечивает защитную реакцию в ответ на «вторжение» патогенных микроорганизмов. Еще одной особенностью наружной мембраны является то, что она буквально «пронизана» поринами — белками, которые формируют каналы, обеспечивающие доступ к цитоплазматической мембране для растворимых в воде веществ.
Но и это далеко не все! Ведь в мембране, помимо всего прочего, находятся различные липопротеины, связывающие внешнюю мембрану с пептидогликановым слоем, в результате чего такой барьер становится еще более прочным. Периплазматическое пространство присуще как Г , так и Г− бактериям.
Обычно в цитоплазматическую мембрану встроены специальные ферменты — транспептидазы, катализирующие последние стадии образования пептидогликана. Также их именуют пенициллинсвязывающими белками (ПСБ). Весьма «говорящее» название, не правда ли?
Обязательно об этом расскажем, но немного позже. А сейчас перейдем непосредственно к пептидогликану. В его синтезе участвуют как минимум два важных фермента-«строителя». Уже вышеупомянутая транспептидаза «сшивает» пентапептидные мостики между собой, а трансгликозилаза позволяет соединять мономеры «NAG—NAM», удлиняя, таким образом, цепочку пептидогликана (рис. 2б).
В целом со строением мембран и клеточной стенки мы разобрались. Давайте перейдем к обсуждению «виновников торжества».
Гликопептиды
Ванкомицин — родоначальник представителей класса гликопептидов — действует только на грамположительных бактерий. Очень долгое время данный препарат считался «лекарством последней надежды», поскольку применялся он в крайних случаях, и к нему не развивалась резистентность.
Но сейчас даже такой «мастодонт» начал потихоньку сдавать свои позиции из-за приобретения бактериями устойчовости к нему. Механизм действия ванкомицина основан на подавлении синтеза клеточной стенки с помощью прямого связывания с терминальной частью пептидного мостика (а именно с D-аланил-D-аланином) липида-II[6–8].
Комплекс «ванкомицин—пентапептид» за счет «стерической изоляции» ванкомицином фрагмента пептидогликана, не позволяет:
Благодаря этому клеточная стенка бактерии становится очень непрочной и подверженной осмотическому давлению, и, как следствие, разрушению (рис. 6).
Относительно новые представители класса гликопептидов, недавно «ворвавшиеся» в клиническую практику, также имеют несколько механизмов действия, основной из которых подобен механизму действия ванкомицина. В дополнение к этому механизму телаванцин нарушает мембранный потенциал бактериальной клетки и увеличивает ее проницаемость, а сопутствующие механизмы далбаванцина и оритаванцина опосредованы через угнетение синтеза РНК и нарушение проницаемости мембраны, однако до конца эти механизмы пока не выяснены [11].
До этого момента мы с вами обсуждали антибиотики, действующие на последних стадиях синтеза клеточной стенки. Но что, если существуют такие препараты, которые могут «работать» на начальных этапах ee образования? Есть и такие в арсенале ученых и врачей: это циклосерин, фосфомицин и бацитрацин (рис. 7) [3].
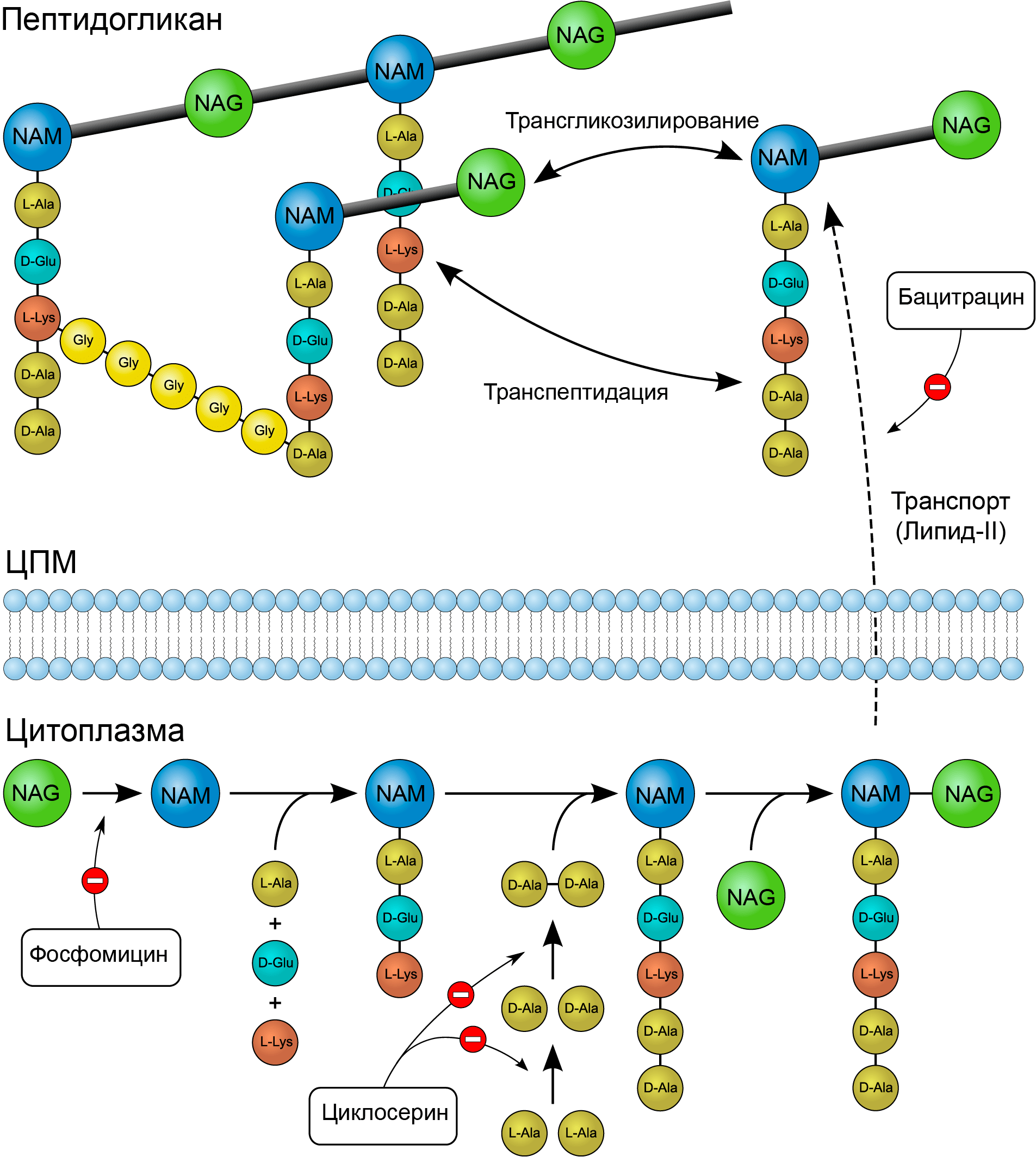
Рисунок 7. Механизмы действия циклосерина, фосфомицина и бацитрацина.Фосфомицин действует на самых ранних этапах образования клеточной стенки. Он подавляет цитоплазматический фермент енолпируваттрансферазу, блокируя присоединение фосфоенолпирувата к UDP-N-ацетилгюкозамину (предшественнику NAM). Циклосерин является структурным аналогом аминокислоты D-аланина. Этот препарат ингибирует включение D-аланина в пентапептид муреина путем подавления активности двух ферментов: аланинрацемазы (превращающающей L-аланин в D-аланин) и D-аланил-D-аланинлигазы (сшивает D-аланил-D-аланин). Бацитрацин, обладающий бактерицидным действием, связывается с активной фосфорилированной формой переносчика, в результате чего не происходит дефосфорилирование липида-II, то есть регенерация его свободной формы. В таком случае не могут осуществиться начальные стадии синтеза пептидогликана, в которых задействован липидный переносчик.
«Википедия», иллюстрация изменена
Но одними препаратами, действующими на клеточную стенку, эта большая группа антибиотиков не ограничивается, поскольку есть еще «мишени» — цитоплазматическая и наружная мембраны.
Даптомицин — представитель группы липопептидов. Его действие направлено преимущественно на устранение Г бактерий. Предполагается, что молекулы препарата связываются с мембраной посредством кальций-зависимой вставки в ее билипидный слой, которая сопровождается образованием поры [12].
В результате этого происходит утечка ионов калия, мембрана деполяризуется. Нарушения электролитного баланса клетки и заряда мембраны ведут к подавлению образования бактериальных ДНК, РНК и белков, из-за чего микроорганизм и погибает (рис. 8) [13].
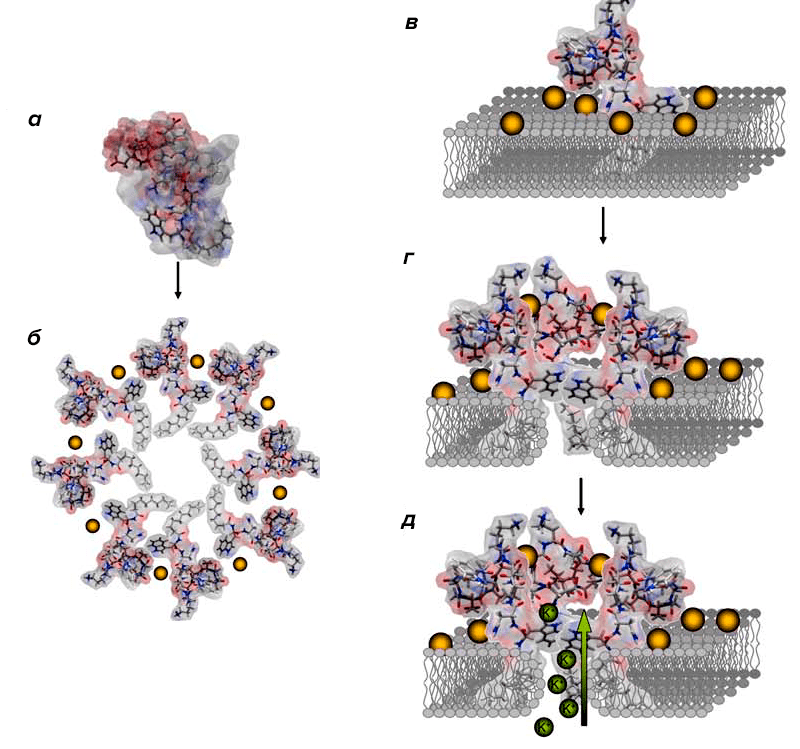
Рисунок 8. Схема действия даптомицина. Даптомицин, несвязанный с ионами кальция (а) обладает низкими амфифильными свойствами. Попадая во внеклеточную жидкость, молекула препарата связывается с Ca2 и меняет свою конформацию благодаря образованию мицелл, повышая при этом свою амфифильность (б). Благодаря этому свойству и своей химической структуре даптомицин взаимодействует с мембраной и вставляется в нее, при чем кальций связывается с фосфатидилглицерольными «головками» липидного слоя мембраны (в). Инсерция антибиотика в мембрану сопровождается еще одним изменением конформации молекулы препарата (г), вызывая при этом деформацию липидного слоя (д), в результате которой образуется пора в мембране. Через такой дефект и происходит утечка ионов калия.
[14]
Грибы
ВВЕДЕНИЕ. Грибам принадлежит важная роль в круговороте веществ в природе, в частности они участвуют в разрушении древесины и образовании гумуса. В симбиозе с высшими растениями (микоризы) грибы помогают им перерабатывать различные вещества.
В то же время некоторые представители грибов являются опасными патогенами растений (например, мучнистая роса). В биотехнологии грибы используют в производстве пищевых продуктов, при получении антибиотиков и ферментов; при утилизации биомассы важную роль играет способность грибов осуществлять разложение органических соединений.
Среди 70 000 видов охарактеризованных грибов наиболее широко представлены сумчатые грибы аскомицеты (около 20 000 видов). В качестве примеров здесь рассмотрены Penicillium notatum и Aspergillus niger. Очень важны в биотехнологии представители фикомицетов – грибы родов Rhizopus и Mucor.
Около 12 000 видов грибов базидиомицетов относятся к съедобным грибам (шампиньоны, лисички, белые грибы и т. д.), а некоторые другие их представители участвуют в разрушении древесины (белый и красный плесневые грибы). Среди грибов встречаются патогенные для человека виды (их около 300). Все грибы – гетеротрофы. Их клеточная стенка содержит хитин, глюкан и в некоторых случаях также целлюлозу.
РАЗМНОЖЕНИЕ ГРИБОВ. Типы размножения грибов чрезвычайно разнообразны, в качестве примера мы рассмотрим размножение сумчатых грибов аскомицетов. Вегетативное тело грибов (таллом) состоит из мицелия – системы ветвящихся нитей (гифы).
При бесполом размножении на концевых выростах мицелия образуются конидиеносцы. В конидиях происходит деление и высвобождение спор, из которых формируется новый мицелий. Как и многие другие грибы, аскомицеты способны к половому размножению. У них существует две различающиеся по облику формы (явление диморфизма), что существенно затрудняет их классификацию.
Гифы формируют мужские и женские половые органы (антеридии и аскогонии соответственно); после протекания плазмогамии образуются дикариотические гифы, дающие начало аскокарпу («плодовому телу»). Затем в концевых клетках дикариотических гиф два ядра сливаются и формируют диплоидную зиготу (этот процесс называется кариогамией).
PENICILLUM NOTATUM растет как мицелий. Он образует плодовые тела с конидиями, из которых высвобождаются споры. Внутри асков созревают споры, прорастающие в новый мицелий. Как и другие представители несовершенных грибов, P. notatum размножается исключительно бесполым путем, поэтому для осуществления рекомбинации в лабораторных условиях проводят слияние протопластов с различными типами ядер (гетерокариоз, парасексуальный процесс). P. notatum и родственный гриб Cephalosporiumacremonium – продуценты важнейших лактамных антибиотиков.
Другим примером биотехнологического применения грибов рода Penicillium является использование Penicillium camamberti при изготовлении сыров. Геном P. notatum имеет размер 32 млн п.н., и к настоящему времени секвенирована лишь небольшая его часть.
ASPERGILLUS NIDULANS – другой представитель аскомицетов, морфологически отличающийся от Penicillium по форме конидий. Размер генома составляет 31 млн п.н. и его структура пока полностью не расшифрована (2005 г.).
В биотехнологии штаммы Aspergillus находят широкое применение: A. oryzae часто служит в качестве организма-хозяина для экспрессии рекомбинантных белков, A. niger является промышленным продуцентом лимонной и глюконовой кислот.
Другие штаммы Aspergillus используются для синтеза внеклеточных ферментов (амилаз и протеиназ), а также в пищевой промышленности (например, в азиатском регионе для приготовления соевого соуса и мисо). Как и в случае Penicillium, для усовершенствования штаммов Aspergillus проводят слияние протопластов с последующим отбором.
RHIZOPUS ORYZAE ИR. NIGRICANS – представители фикомицетов, растущие на рисе и хлебе соответственно. Гифы этих грибов растут чрезвычайно быстро и буквально пронизывают питательную среду.
Бесполое размножение фикомицетов происходит с образованием спор в специализированном мицелии – спорангиях. Представители родов Rhizopus и Mucor находят широкое применение в биотехнологии, так как в процессе разложения органического субстрата они выделяют в среду разнообразные внеклеточные ферменты.
Дрожжи
ВВЕДЕНИЕ. Дрожжи – это группа грибов, не имеющих типичного мицелия и размножающихся почкованием. К дрожжам относят представителей различных классов грибов. Дрожжи – гетеротрофные организмы, предпочитающие для роста кислые среды (рН 3,5–5,0).
Клеточная стенка этих организмов содержит хитин. В биотехнологии наиболее важные следующие дрожжи: Saccharomyces cerevisiae, Candida utilis,Candidaalbicans, Schizosaccharomycespombe, Hansenulapolymorphaи Pichiapastoris.
SACCHAROMYCES CEREVISIAE (пекарские дрожжи) могут размножаться как в гаплоидной, так и в диплоидной форме, поэтому они являются излюбленным объектом для генетических исследований. Гаплоидные штаммы, используемые в лабораторной практике, принадлежат одному из двух типов спаривания – MATa или MATα.
Скрещивание возможно только между представителями разных типов спаривания. Бесполое (вегетативное) размножение осуществляется почкованием гаплоидных или диплоидных клеток. При половом размножении происходит слияние двух гаплоидных клеток, и в результате мейоза образуются четыре гаплоидные аскоспоры.
Выводы о генетических изменениях можно делать, исходя из визуального (с помощью микроскопа) анализа аскоспор (тетрадный анализ). Поскольку и в гаплоидной, и в диплоидной формах эти дрожжи – неприхотливая и устойчивая культура, для которой в оптимальных условиях время удвоения составляет всего 90 мин, S. cerevisiae – очень ценный объект для молекулярно-генетических экспериментов.
Нуклеотидная последовательность генома S. cerevisiae полностью расшифрована (12 млн п.н. находятся в 46 хромосомах). Наличие в клетках внехромосомных элементов (2 -плазмиды, присутствующей в количестве 60–100 копий на клетку) также является преимуществом этого вида дрожжей, так как открывает новые возможности для осуществления рекомбинации.
Для трансформации клеток S. cerevisiae разработано множество векторных конструкций: при использовании одних векторов чужеродная ДНК реплицируется в клетке независимо (YRP – yeast replicating plasmid и YEP – yeast episomal plasmid), а другие век торы позво ляют чужеродной ДНК встраи ваться в дрожжевые хромосомы (YIP – yeast integrating plasmid).
Искусственные дрожжевые хромосомы (YAC – yeast artificial chromosome) позволяют клонировать очень крупные фрагменты ДНК (600–1400 т. п. н.), поэтому их часто используют для создания геномных библиотек. Недостатком такой системы является высокая частота внутри хромосомной рекомбинации, поэтому в последнее время искусственные дрожжевые хромосомы все чаще заменяют на бактериальные искусственные хромосомы (ВАС).
Около 6000 генов S. cerevisiae в высокой степени гомологичны генам человека, поэтому эти дрожжи часто служат в качестве модельной системы при изучении молекулярно-биологических механизмов обмена веществ. В биотехнологии они используются в пищевой промышленности, для производства алкогольных напитков, этанола, а также для промышленного получения рекомбинантных белков, например α-интерферона, и различных вакцин, в том числе поверхностного антигена вируса гепатита В.
В отличие от систем экспрессии с использованием E. coli, в клетках S. cerevisiae белки претерпевают посттрансляционную модификацию (например, гликозилирование), поэтому дрожжи используют для получения эукариотических белков, для функционирования которых необходимы такие модификации.
CANDIDA UTILIS – представитель группы дрожжей, который формирует мицелий и размножается исключительно почкованием. В геноме C. utilis встречаются неканонические кодоны (например, CUG, обычно кодирующий лейцин, в этом организме кодирует серин), поэтому гетерологическая экспрессия в C. utilis крайне затруднена.
Штаммы C. utilis применяют в биотехнологическом производстве внеклеточных ферментов, а в сельском хозяйстве – как кормовую добавку. Грибы рода Candida могут использовать в качестве источника углерода такие необычные вещества, как фракции нефти или сульфитсодержащие производные, поэтому они имеют особенно важное значение при утилизации различных отходов. Некоторые представители рода Candida для человека патогенные (Candida albicans).
PICHIAPASTORIS И HANSENULA POLYMORPHA– представители метилотрофных дрожжей, использующих в качестве единственного источника углерода метанол.
Метилотрофные дрожжи активно изучаются с целью использования для экспрессии эукариотических генов. Так, в клетках Pichia pastoris удалось осуществить очень эффективный синтез различных белков: липаз, β-интерферона и фрагментов антител (до 12 г рекомбинантного белка на литр культуры).
SCHIZOSACCHAROMYCES POMBEвпервые были выделены из восточно-африканского пива (пиво на язык суахили – pombe). Геном S. pombe, распределенный всего между тремя хромосомами, полностью расшифрован: его размер составляет 12,6 млн п.н., что сравнимо с размером генома S. cerevisiae, но всего по трем хромосомам, несущим почти по 5000 генов.
Наше секретное оружие (*в стадии бета-тестирования)
Как вы уже поняли, АБР приобрела невероятные масштабы. Бактерии непрерывно совершенствуют стратегии самозащиты, вариативность которых растет с каждым годом. Ко многим классам препаратов (даже к тем, что совсем недавно пришли в клиническую практику) уже сформировалась устойчивость.
Помните, когда мы обсуждали антибиотики, влияющие на начальные этапы синтеза клеточной стенки, упоминался мембранный переносчик под названием липид-II? Так вот, эта молекула является одной из самых популярных мишеней у альтернатив обычным антибиотикам.
И это неудивительно: нарушим работу этого переносчика — нарушим образование клеточной стенки, столь важного компонента клетки бактерии. Напомню, что структура липида-II весьма разнородна. На его белковую часть нацелены многие антибиотики — ванкомицин и другие представители класса гликопептидов.
Самый большой минус этих препаратов — их мишень: пентапептид может легко измениться в результате мутации, благодаря чему бактерия приобретает устойчивость. А, например, пирофосфат — другой компонент молекулы липида-II (небелковой природы) — весьма консервативен, поэтому микроорганизмам будет очень и очень непросто стать неуязвимыми к препаратам, влияющим на эту часть транспортной молекулы.
Одной из таких групп являются лантибиотики, ярчайший представитель которых — низин[66]. Это антибактериальное вещество открыли даже раньше «прародителя» всех антибиотиков — пенициллина! Механизм действия низина (а также близких к нему низиноподобных липопептидов) заключается в том, что он связывает пирофосфатный фрагмент липида-II и формирует поры в бактериальной мембране, что приводит к лизису и гибели клеток [9].
К сожалению, по ряду причин (плохие фармакокинетические свойства и нестабильность молекулы) низин не используется в клинической практике (по крайней мере, на данный момент), однако ему нашли другое применение — в пищевой промышленности в качестве консерванта.
Но ученые просто так не сдаются, сейчас они активно изучают эти молекулы, пытаясь усовершенствовать их, чтобы использовать и в медицине. Другим представителем лантибиотиков является микробиспорицин[34]. Его место связывания соответствует таковому у низина, но его механизм направлен на остановку образования пептидогликана и накопление его предшественников в цитоплазме клетки бактерии.
Существуют и другие молекулы, нацеленные на «многострадальный» липид-II. Например, недавно открытый тейксобактин (рис. 21), на который возлагают большие надежды [34]. Многие ученые считают, что именно он призван заменить ванкомицин!
Ведь кроме того, что он связывается с небелковой частью переносчика (а именно с его пирофосфатом и одним из аминосахаров), тейксобактин способен влиять и на другую молекулу — липид-III, нарушая синтез тейхоевых кислот грамположительных бактерий. Сейчас препарат находится в клинических испытаниях.
Кроме липида-II, существуют и другие мишени, например, тейхоевые и липотейхоевые кислоты Г микроорганизмов. Конечно, они являются менее важной частью бактериального барьера, нежели пептидогликан, но если нарушить их образование, то, скорее всего, можно изрядно подпортить жизнь бактериям.
Не стоит забывать и про старые мишени — рибосомы. Например, совсем недавно, в 2021 году, обнаружили новый пептидный антибиотик при изучении Klebsiella pneumoniae — одного из возбудителей пневмонии [67]. Это соединение назвали «в честь» данной бактерии — клебсазолицин.
Механизм его работы очень схож с механизмами работы макролидов (эритромицина) и стрептограминов (хинупристина): он ингибирует синтез белка, связываясь с бактериальной рибосомой в туннеле выхода пептида (рис. 22). По итогам опытов «в пробирке» клебсазолицин доказал свою эффективность, особенно в отношении Г− бактерий [68].
Кстати, все вышеперечисленные препараты с антибактериальной активностью (лантибиотики, клебсазолицин, тейксобактин, ванкомицин и др.) можно объединить в одну огромную группу — антимикробные пептиды (АМП) [69]. Растения, животные, грибы и даже сами бактерии имеют абсолютно разный врожденный иммунитет, но в кое-чем сходны: все они образуют эти пептиды, губительно влияющие на бактерий. Разнообразие АМП поражает воображение.
Выделяют два основных типа воздействия антимикробных пептидов на клетки: подавление метаболических процессов (например лантибиотики) и нарушение целостности цитоплазматической мембраны. Большинство антимикробных пептидов вызывает гибель клетки по второму механизму.
Многие АМП пользуются фундаментальным отличием бактериальной мембраны от эукариотической — зарядом. Благодаря своему положительному заряду эти пептиды «отыскивают» отрицательно заряженные мембраны бактерий, интегрируются в них, вызывая деформации ЦПМ (обычно в виде поры), что и приводит к гибели микроорганизма.
Некоторые из них находятся уже на стадии клинических исследований (например рамопланин). К сожалению, большинство из них пока нельзя применять системно, поэтому врачи ограничиваются местным, но довольно успешным применением.
Нельзя обойти стороной и бактериофагов. Как мы уже ранее выяснили, эти вирусы могут служить во благо бактерий, помогая им осуществлять ГПГ. Но, оказывается, ученые нашли им другое применение. Да, все верно — с помощью бактериофагов можно лечить бактериальные инфекции, в том числе вызванные АБР-микроорганизмами.
Когда-то давно, чуть меньше ста лет назад, проводили множество исследований по клиническому применению бактериофагов, однако стабильных результатов получено не было. Но в связи с проблемой АБР исследователи начали возвращаться к этому способу лечения, несмотря на его недостатки. Бактериофагам посвящена целая статья на «Биомолекуле» [46].
Заключение
Сейчас хоть и проводится огромное множество исследований, ученым и врачам все сложнее и сложнее что-либо противопоставить патогенным бактериям. Устойчивость к антибиотикам с каждым разом появляется все быстрее, а микрорганизмы действуют все ухищреннее, «придумывая» новые варианты защиты, которыми делятся со своими «товарищами». Парадокс: модифицируем антибиотики — патогены приобретают новую устойчивость, и так происходит почти постоянно.
Да, существуют альтернативы антибиотикам, к которым не развивается устойчивость. Скорее всего, за ними будущее, но должно пройти как минимум несколько лет, чтобы их начали использовать в клинической практике. И, конечно, у них есть и другие недостатки, которые предстоит исправить.

Рисунок 23. Разработка антибиотиков — как игра в шахматы. Как только ученые делают ход, бактерии совершают ответный незамедлительно. Любителей бьют!
Predicting Superbugs’ Countermoves to New Drugs
Теория Дарвина гласит: «выживает не самый сильный, а наиболее приспособленный». Кто же в данной ситуации окажется наиболее приспособленным — человечество или бактерии? Вопрос времени. Однако знание механизмов действия, мишеней антибиотиков и механизмов устойчивости к ним обязательно окажет нам услугу в создании новых способов борьбы против бактерий в этой беспощадной «бесконечной войне», унесшей уже множество тысяч жизней.
- Липидный фундамент жизни;
- Cowan M.K. Microbiology: a systems approach (3rd Edition). McGraw–Hill Publishing Company, 2021. — 740 p.;
- Katzung B.G., Masters S.B., Trevor A.J. Basic & clinical pharmacology. McGraw–Hill Education, 2021;
- Победитель бактерий;
- Karen Bush, Patricia A. Bradford. (2021). β-Lactams and β-Lactamase Inhibitors: An Overview. Cold Spring Harb Perspect Med. 6, a025247;
- Элементы: «Картинка дня — ванкомицин»;
- Hee-Kyoung Kang, Yoonkyung Park. (2021). Glycopeptide Antibiotics: Structure and Mechanisms of Action. J Bacteriol Virol. 45, 67;
- Daina Zeng, Dmitri Debabov, Theresa L. Hartsell, Raul J. Cano, Stacy Adams, et. al.. (2021). Approved Glycopeptide Antibacterial Drugs: Mechanism of Action and Resistance. Cold Spring Harb Perspect Med. 6, a026989;
- Элементы: «Компьютерное моделирование мембран, липид-II и покрывало Пенелопы»;
- Elisa Binda, Flavia Marinelli, Giorgia Marcone. (2021). Old and New Glycopeptide Antibiotics: Action and Resistance. Antibiotics. 3, 572-594;
- George G. Zhanel, Frank Schweizer, James A. Karlowsky. (2021). Oritavancin: Mechanism of Action. Clinical Infectious Diseases. 54, S214-S219;
- Scott D. Taylor, Michael Palmer. (2021). The action mechanism of daptomycin. Bioorganic & Medicinal Chemistry. 24, 6253-6268;
- J. A. Silverman, N. G. Perlmutter, H. M. Shapiro. (2003). Correlation of Daptomycin Bactericidal Activity and Membrane Depolarization in Staphylococcus aureus. Antimicrobial Agents and Chemotherapy. 47, 2538-2544;
- Suzana K. Straus, Robert E.W. Hancock. (2006). Mode of action of the new antibiotic for Gram-positive pathogens daptomycin: Comparison with cationic antimicrobial peptides and lipopeptides. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1758, 1215-1223;
- Nicolas Grégoire, Vincent Aranzana-Climent, Sophie Magréault, Sandrine Marchand, William Couet. (2021). Clinical Pharmacokinetics and Pharmacodynamics of Colistin. Clin Pharmacokinet. 56, 1441-1460;
- Daniel N. Wilson. (2021). Ribosome-targeting antibiotics and mechanisms of bacterial resistance. Nat Rev Microbiol. 12, 35-48;
- I. Chopra, M. Roberts. (2001). Tetracycline Antibiotics: Mode of Action, Applications, Molecular Biology, and Epidemiology of Bacterial Resistance. Microbiology and Molecular Biology Reviews. 65, 232-260;
- Fabian Nguyen, Agata L. Starosta, Stefan Arenz, Daniel Sohmen, Alexandra Dönhöfer, Daniel N. Wilson. (2021). Tetracycline antibiotics and resistance mechanisms. Biological Chemistry. 395, 559-575;
- Daniel N. Wilson. (2009). The A–Z of bacterial translation inhibitors. Critical Reviews in Biochemistry and Molecular Biology. 44, 393-433;
- Krishna Kannan, Alexander S. Mankin. (2021). Macrolide antibiotics in the ribosome exit tunnel: species-specific binding and action. Annals of the New York Academy of Sciences. 1241, 33-47;
- Karen L. Leach, Steven M. Swaney, Jerry R. Colca, William G. McDonald, James R. Blinn, et. al.. (2007). The Site of Action of Oxazolidinone Antibiotics in Living Bacteria and in Human Mitochondria. Molecular Cell. 26, 393-402;
- D. N. Wilson, F. Schluenzen, J. M. Harms, A. L. Starosta, S. R. Connell, P. Fucini. (2008). The oxazolidinone antibiotics perturb the ribosomal peptidyl-transferase center and effect tRNA positioning. Proceedings of the National Academy of Sciences. 105, 13339-13344;
- Karen L. Leach, Steven J. Brickner, Mark C. Noe, Paul F. Miller. (2021). Linezolid, the first oxazolidinone antibacterial agent. Annals of the New York Academy of Sciences. 1222, 49-54;
- Maria Ramirez, Marcelo Tolmasky. (2021). Amikacin: Uses, Resistance, and Prospects for Inhibition. Molecules. 22, 2267;
- Anton Vila-Sanjurjo, Ying Lu, Jamie L. Aragonez, Rebekah E. Starkweather, Manoj Sasikumar, Michael O’Connor. (2007). Modulation of 16S rRNA function by ribosomal protein S12. Biochimica et Biophysica Acta (BBA) – Gene Structure and Expression. 1769, 462-471;
- Bernd Becker, Matthew A. Cooper. (2021). Aminoglycoside Antibiotics in the 21st Century. ACS Chem. Biol.. 8, 105-115;
- Lorenzo Zaffiri, Jared Gardner, Luis H. Toledo-Pereyra. (2021). History of Antibiotics. From Salvarsan to Cephalosporins. Journal of Investigative Surgery. 25, 67-77;
- Jerry D. Smilack. (1999). Trimethoprim-Sulfamethoxazole. Mayo Clinic Proceedings. 74, 730-734;
- Rang H.P., Ritter J.M., Flower R.J. et al. Rang and Dale’s: Pharmacology (8th Edition). Churchill Livingstone, 2021. — 776 p.;
- James J. Champoux. (2001). DNA Topoisomerases: Structure, Function, and Mechanism. Annu. Rev. Biochem.. 70, 369-413;
- Drlica K. and Zhao X. (1997). DNA gyrase, topoisomerase IV, and the 4-quinolones. Microbiol. Mol. Biol. Rev.61, 377–392;
- David C. Hooper, George A. Jacoby. (2021). Topoisomerase Inhibitors: Fluoroquinolone Mechanisms of Action and Resistance. Cold Spring Harb Perspect Med. 6, a025320;
- Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Julie Ann Perry, Erin Louise Westman, Gerard D Wright. (2021). The antibiotic resistome: what’s new?. Current Opinion in Microbiology. 21, 45-50;
- РНК-полимераза, горизонтальный перенос генов и связь поколений в лаборатории молекулярной генетики микроорганизмов ИМГ РАН;
- Эволюция наперегонки, или Почему антибиотики перестают работать;
- Alfonso J. Alanis. (2005). Resistance to Antibiotics: Are We in the Post-Antibiotic Era?. Archives of Medical Research. 36, 697-705;
- Linus Sandegren, Dan I. Andersson. (2009). Bacterial gene amplification: implications for the evolution of antibiotic resistance. Nat Rev Microbiol. 7, 578-588;
- Alison H Holmes, Luke S P Moore, Arnfinn Sundsfjord, Martin Steinbakk, Sadie Regmi, et. al.. (2021). Understanding the mechanisms and drivers of antimicrobial resistance. The Lancet. 387, 176-187;
- R. Craig MacLean, Alvaro San Millan. (2021). The evolution of antibiotic resistance. Science. 365, 1082-1083;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Тайны «молекулярных паразитов», или Как путешествовать по геному;
- Геном человека: полезная книга, или глянцевый журнал?;
- Геном человека: как это было и как это будет;
- Пожиратели бактерий: убийцы в роли спасителей;
- John Chen, Nuria Quiles-Puchalt, Yin Ning Chiang, Rodrigo Bacigalupe, Alfred Fillol-Salom, et. al.. (2021). Genome hypermobility by lateral transduction. Science. 362, 207-212;
- Jennifer R Huddleston. (2021). Horizontal gene transfer in the human gastrointestinal tract: potential spread of antibiotic resistance genes. IDR. 167;
- Christopher Walsh. (2000). Molecular mechanisms that confer antibacterial drug resistance. Nature. 406, 775-781;
- P. M Hawkey. (1998). The origins and molecular basis of antibiotic resistance. BMJ. 317, 657-660;
- Stuart B. Levy. (1998). The Challenge of Antibiotic Resistance. Sci Am. 278, 46-53;
- Один в поле не воин: природная антимикробная система эффективнее антибиотика;
- Katarzyna M. Mickiewicz, Yoshikazu Kawai, Lauren Drage, Margarida C. Gomes, Frances Davison, et. al.. (2021). Possible role of L-form switching in recurrent urinary tract infection. Nat Commun. 10;
- Hilary D. Marston, Dennis M. Dixon, Jane M. Knisely, Tara N. Palmore, Anthony S. Fauci. (2021). Antimicrobial Resistance. JAMA. 316, 1193;
- K. Poole. (2005). Aminoglycoside Resistance in Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 49, 479-487;
- G WRIGHT. (2005). Bacterial resistance to antibiotics: Enzymatic degradation and modification. Advanced Drug Delivery Reviews. 57, 1451-1470;
- Georgina Cox, Gerard D. Wright. (2021). Intrinsic antibiotic resistance: Mechanisms, origins, challenges and solutions. International Journal of Medical Microbiology. 303, 287-292;
- P LAMBERT. (2005). Bacterial resistance to antibiotics: Modified target sites. Advanced Drug Delivery Reviews. 57, 1471-1485;
- Cesar A. Arias, Barbara E. Murray. (2021). The rise of the Enterococcus: beyond vancomycin resistance. Nat Rev Micro. 10, 266-278;
- Yi-Yun Liu, Yang Wang, Timothy R Walsh, Ling-Xian Yi, Rong Zhang, et. al.. (2021). Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. The Lancet Infectious Diseases. 16, 161-168;
- Roland Leclercq. (2002). Mechanisms of Resistance to Macrolides and Lincosamides: Nature of the Resistance Elements and Their Clinical Implications. Clinical Infectious Diseases. 34, 482-492;
- Yohei Doi, Jun-ichi Wachino, Yoshichika Arakawa. (2021). Aminoglycoside Resistance. Infectious Disease Clinics of North America. 30, 523-537;
- Liam S. Redgrave, Sam B. Sutton, Mark A. Webber, Laura J.V. Piddock. (2021). Fluoroquinolone resistance: mechanisms, impact on bacteria, and role in evolutionary success. Trends in Microbiology. 22, 438-445;
- José Manuel Rodríguez-Martínez, Carmen Velasco, Álvaro Pascual, María Eliecer Cano, Luis Martínez-Martínez, et. al.. (2021). Plasmid-mediated quinolone resistance: an update. Journal of Infection and Chemotherapy. 17, 149-182;
- Ряскина Д. (2021). Альтернативы антибиотикам. «Медач»;
- Микробиологические войны: чем бактерии воюют друг с другом;
- Антибиотики, структура генома и CRISPR: чем занимается в Сколтехе лаборатория Северинова;
- Mikhail Metelev, Ilya A Osterman, Dmitry Ghilarov, Nelli F Khabibullina, Alexander Yakimov, et. al.. (2021). Klebsazolicin inhibits 70S ribosome by obstructing the peptide exit tunnel. Nat Chem Biol. 13, 1129-1136;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Полимеры в борьбе с антибиотикорезистентными микроорганизмами.








